隨著CT篩查的普及,我們發現了越來越多的早期肺癌。
對這部分患者而言,積極的手術治療往往是最好的選擇。
但是,手術以後效果如何呢?
儘管原位腺癌(AIS)、微小浸潤性腺癌(MIA)都已經證明可以透過手術實現根治效果,而永不復發。
詳見既往文章<肺癌可以被治癒嗎?>
但絕大多數的浸潤性肺腺癌卻做不到。
比如,有學者分析了四川華西醫院接受手術切除的1387例I期肺癌患者的生存結局。
發現在5年的隨訪過程中,有將近20.2%的患者會出現復發。
從手術到復發的平均間隔是25.5月。
即,就算早期,也不能治癒。
有什麼辦法可以預測療效
那有沒有好辦法可以知道自己的治療效果如何呢?
目前,常用的方法,是基於CT的影像學表現。
比如,鄭醫生之前的一個帖子就跟大家分享過,早期肺癌,只要影像學上有毛玻璃,5年總生存率都高於90%。
即早期肺癌,只要有毛,就不要擔心。
詳見既往文章<有這種特徵的早期肺癌,5年生存率都高於90%!>
但,影像學表現再厲害,也是外在的。
而真正決定一個腫瘤的內在生物學行為,是病理。
簡單來說,純毛玻璃肺癌之所以效果很好,因為這裡面幾乎都是原位腺癌和微小浸潤性腺癌。
純毛玻璃是表象,而原位腺癌/微小浸潤性腺癌是本質。
那既然病理如此重要,為什麼我們不能更好地挖掘一下呢?
畢竟,它才是核心,才是本質。
肺腺癌的病理分型
2011年,IASLC/ATS/ERS基於肺腺癌的生物學特點,提出了五大生長模式:
貼壁生長型、腺泡型、乳頭型、微乳頭狀以及實性生長型。
並基於各自的侵襲特點進行了劃分。
低度侵襲性是貼壁生長型;
中度侵襲性是腺泡型、乳頭狀生長型;
高度侵襲性是微乳頭狀以及實性生長型。
除此之外,複雜腺樣生長型(比如粘液腺癌)也屬於高度侵襲性。
這是一個偉大的發明,標誌著肺癌的病理劃分進入了徹底的微觀時代。
用人類社會做比喻。
在這個分類沒出來之前,我們只有男人和女人。
在這個分類出來以後,我們有了綠茶女、鳳凰男、文藝範、留守兒童、空巢老人等一系列標籤,社會一下子層次分明起來。
到底哪個更重要?
但是,實際情況下,每個病人的標本中,往往混雜有多種生長模式。
比如下面這個報告,就是貼壁型30%、腺泡型40%、乳頭型30%、微乳頭5%。
那,效果到底如何呢?
既然低度侵襲性的生長模式可能療效更好,
而高度侵襲性的生長模式可能療效更差。
那到底誰的影響力更大呢?
2020年,一個發表在肺癌殿堂級雜誌<Journal of Thoracic Oncology>上的研究給出了答案。
在這個研究中,作者從多箇中心蒐集到796名I期浸潤性肺腺癌患者。
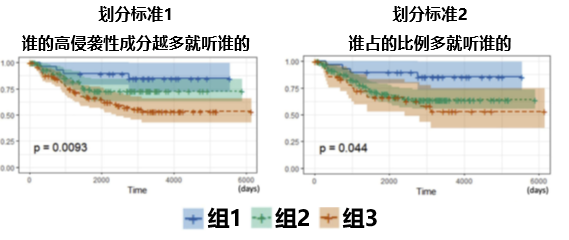
作者基於他們的病理報告,採取了兩種截然不同的劃分標準,對整組人群進行了劃分,並比較不同劃分標準的合理性。
劃分標準1——誰的高侵襲性成分越多就聽誰的。
基於這個標準,整體人群被劃分為3個大組:
組1:以貼壁生長為主,而微乳頭/實性/複雜腺體生長成分不足20%;
組2:以乳頭、腺泡生長為主,而微乳頭/實性/複雜腺體生長成分不足20%;
組3:微乳頭/實性/複雜腺體生長成分超過20%。
劃分標準2——誰佔的比例多就聽誰的。
基於這個標準,整體人群被劃分為3個大組:
組1:以貼壁生長為主型;
組2:以乳頭、腺泡生長為主型;
組3:以微乳頭/實性/複雜腺體生長為主型。
結果發現,標準1實現了更好的預後風險分層。
即,影響肺腺癌生物學行為的最重要因素,是高度侵襲性腺癌成分的比例。
肺癌的生物學行為,也遵循短板效應。
即真正對一個肺癌起決定作用的,不是它的低度侵襲性成分佔多少,而是高度侵襲性成分有多少比例。
還能更精細些嗎?
順著這個思路,自然而然就有人會提出這個問題。
那是不是高侵襲性成分越多,效果就越差呢?
2022年,發表在<Annals of Surgical Oncology>上的一個研究回答了這個問題。
在這個研究中,作者回顧性納入1049例接收手術的病理I期浸潤性肺腺癌患者。
透過篩選得到191名納入研究。
篩選標準即,這個患者的肺癌病理成分中,必須有至少1%的高度侵襲性成分。
在後續的研究中,作者基於其高侵襲性成分的比例將全組人群劃分為4組:
組1:高侵襲性成分≤30%
組2:高侵襲性成分31-55%
組3:高侵襲性成分56%-85%
組4:高侵襲性成分≥86%
果然,高侵襲性成分越高的患者,復發越快。
可以透過病理報告,算生存率嗎?
現在,就要進入這篇文章的正題了。
既然,我們已經知道肺腺癌的病理生長模式的預後影響,那能不能透過病理報告,預測出遠期的生存效果呢?
答案是,可以的。
相關研究來自國內巨頭天津腫瘤醫院的王長利教授團隊,並於2022年3月發表在<Journal of Surgical Oncology>期刊上。
在這個研究中,作者回顧性納入595名I期浸潤性肺腺癌的臨床資訊。
基於病理報告結果,計算得到微乳頭及實性生長腺癌總比例(TPSM)。
TPSM=微乳頭生長百分比+實性生長百分比
將TPSM劃分為3組:
TPSM低表達組(TPSM-L),即TPSM<10%;
TPSM中表達組(TPSM-M),即TPSM≥10且<40%;
TPSM高表達組(TPSM-H),即TPSM≥40%。
不出所料,TPSM分層能很好地實現對復發/死亡風險的預測。
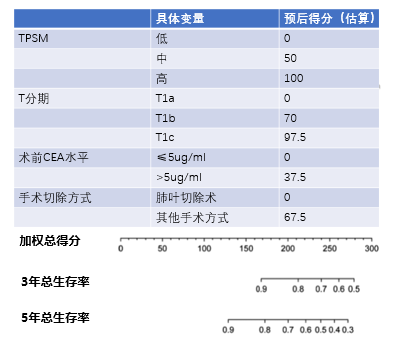
在經過一系列統計分析,最終得到可以有效預測療效的nomogram預測模型。
nomogram模型,簡單來說,就是預後模型的視覺化。
即透過這個模型,可以提取到每個預後變數的預後權重得分。
那麼,透過計算某個個體的全部預後變數的總分數,就可以對應出其相應的3年、5年腫瘤的腫瘤控制率和總生存率。
最終,在總生存預測方面,得到以下結果:
如何解讀呢?
第一步:就是把自己的臨床變數挨個對上去,得到一個加權分;
第二步:把每個加權分相加得到一個總分;
第三步:對應這個總分去下面匹配對應的3年和5年生存率。
舉個例子:
患者A,TPSM-L、肺腺癌T分期T1b、術前CEA水平8ug/ml、最終接受了肺葉切除術。
那麼它的加權分就分別是0分、70分、37.5分和0分,最終總分107.5分。
對應下面的3年和5年生存率,均大於90%。
在無複發率預測方面,得到以下結果:
值得注意的是,這個測模型的c-index指數,在總生存率是0.76,而在無複發率方面則是0.67。
目前的研究資料中,一個模型一旦c-index突破0.8,是該模型準確可靠的重要標誌。
因此,天津腫瘤醫院這個研究中,所得到的總生存率的預測相對可靠,而無複發率方面的預測,則可能存在一定的偏倚。
但是,有總好過沒有吧。
寫在最後
臨床上常常遇到一個現象。
相同分期的早期肺腺癌患者,手術效果卻大相徑庭。
這裡面,可能就是病理亞型在起作用。
比如,同樣的I期的微乳頭為主型的腺癌和貼壁生長為主型的腺癌,侵襲性不同,自然效果不一樣。
可能有人會說,鄭醫生,你今天只說了病理亞型,可是關於淋巴血管浸潤、以及最新的氣腔播散(STAS)卻壓根沒有提。
你的結論可能不準確哦,因為這些因素都可能對預後有影響。
沒錯,你說得對。
但是,這些因素的背後,依然是病理亞型。
比如,前面2020年<Journal of Thoracic Oncology>的研究就發現,氣腔播散作為一個重要的預後因素,只見於那些含有高侵襲性成分(微乳頭/實性/複雜腺體生長)的肺腺癌患者中;
即沒有高侵襲成分的肺腺癌,壓根就不會出現氣腔播散。
而在2022年<Annals of Surgical Oncology>的研究則發現,淋巴血管侵犯(LVI)在高侵襲成分越高的腺癌患者中越多見;
而當淋巴血管侵犯和病理侵襲成分共同納入分析後,淋巴血管侵犯則立刻失去臨床意義。
狐假虎威:誰是狐狸,誰是老虎,一目瞭然。
我們現在常常說毛玻璃肺癌的預後如何如何。
但在我看來,所謂的CT表現,都是構建在病理亞型的基礎上。
在隨訪階段,我們可以說,這個結節有毛玻璃成分,危害性不大。
但是在手術以後,在取得了具體的病理報告以後,則更應該深入挖掘病理報告的預後資訊。
畢竟,肺癌發展這麼多年,早已進入了微觀世界。
用放大鏡就可以看的CT影象,自然比不過用顯微鏡才能出具的病理報告。
早期肺腺癌術後患者,想了解具體遠期療效如何?
很簡單呀,拿出病理報告,好好比對一下前文的圖表,就知道了。
萬事不求人,多好。
參考文獻:
1. Clinicopathological variables influencing overall survival, recurrence and post-recurrence survival in resected stage I non-small-cell lung cancer. BMC Cancer.020 Feb 24;20(1):150.
2. A Grading System for Invasive Pulmonary Adenocarcinoma: A Proposal From the International Association for the Study of Lung Cancer Pathology Committee. Thorac Oncol. 2020 Oct;15(10):1599-1610.
3. Percentage of Newly Proposed High-Grade Patterns Is Associated with Prognosis of Pathological T1-2N0M0 Lung Adenocarcinoma. Ann Surg Oncol. 2022 Feb 24.
4. A prognostic nomogram based on a new classification of combined micropapillary and solid components for stage IA invasive lung adenocarcinoma. J Surg Oncol. 2022 Mar;125(4):796-808.