1,存在
(1)分佈廣:地殼上的岩石、土壤和沙子的主要成分都是矽的氧化物和矽酸鹽。約佔地殼質量的90%以上。
(2)含量多:含26.3%,居第二位。 (3)化合態:自然界中矽全部都存在於化合物中,無遊離態(親氧性較碳強)。 水晶,瑪瑙,沙石等物質的主要成分為二氧化矽。
2,結構
二氧化矽晶體是一種空間網狀結構 二氧化矽晶體中沒有SiO2分子,“SiO2”是二氧化矽的化學式,不是其分子式。
3,物理性質
砂石硬度大熔點高、石英可做坩堝——SiO2的硬度大熔點高。
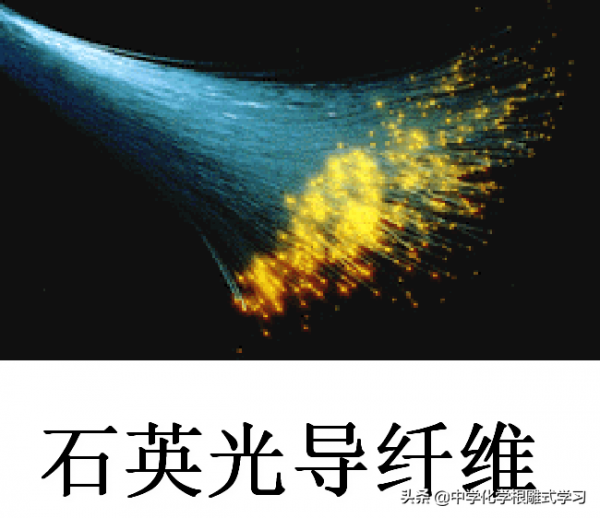
石英和光導纖維是無色透明的— 純淨的SiO2是無色的。
砂石的化學性質穩定—SiO2的化學性質穩定。
SiO2的這些性質都是由其空間網狀結構決定的。
所以性質決定用途,用途反映性質。
4,化學性質
(1)SiO2的化學性質很不活潑,酸中只有氫氟酸(HF)能與之反應。
SiO2+4HF=SiF4↑+2H2O
玻璃中含有SiO2 ,可以用HF刻蝕玻璃。
(2)SiO2 是酸性氧化物,可與鹼性氧化物和鹼反應。
SiO2+2NaOH=Na2SiO3+H2O
實驗室中裝盛NaOH 的試劑瓶用橡皮塞或軟木塞而不用玻璃塞(玻璃中含有SiO2,其與NaOH反應生成的Na2SiO3會把玻璃塞和瓶粘在一起。時間長了,瓶塞就打不開)
所以二氧化矽是酸性氧化物,不是鹼性氧化物。
5,二氧化矽的特性
(1)酸性氧化物一般能與水反應生成對應的酸,但SiO2不溶於H2O,不能直接與H2O反應生成H2SiO3。
(2)非金屬氧化物的熔點一般較低,但二氧化矽的熔點很高。
(3)酸性氧化物一般不與酸反應,但SiO2可以與氫氟酸反應:SiO2+4HF===SiF4↑+2H2O。