GEMSTONE-301研究是繼PACIFIC研究後第2個在局晚期放療與化療結束後,證實免疫維持治療有效的III期隨機對照研究,研究資料已經於近期發表於《Lancet Oncology》雜誌。作為兩個重磅研究,兩者的研究設計、人群特點等有哪些不同?本期筆者與大家一起分享GEMSTONE-301研究與PACIFIC研究的差異。
一、前情回顧
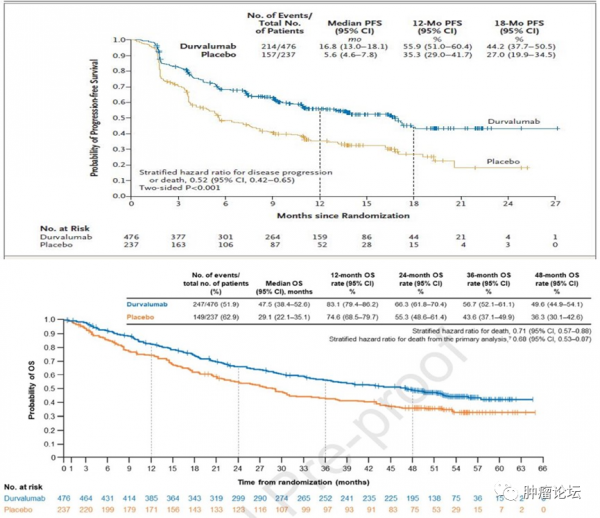
首先,先來大概瞭解一下兩項研究。PACIFIC研究探索的是對於區域性晚期且同步放化療後未進展的患者,給予不超過1年的PD-L1抑制劑——Durvalumab鞏固治療的療效及安全性。符合入組標準的患者,按照2:1的比例進行隨機,Durvalumab的劑量為10mg/kg,每2週一次,治療上限為1年。放療劑量為常規的54-66Gy。強化治療期間出現2度及以上不良反應且隨機化之前未解決的患者不允許入組。除此以外,排除標準無特殊。研究基於性別、年齡(以65歲為分界點)及吸菸狀態進行分層。研究的PFS及OS資料均登頂《新英格蘭醫學雜誌》。資料顯示,免疫治療組和安慰劑組的中位PFS分別為16.8個月和5.6個月,將疾病進展/死亡風險降低48%,兩組的中位OS分別為47.5個月和29.1個月,HR=0.71。兩組3度及以上不良反應發生率分別為29.9%和26.1%,其中最常見的還是肺炎,兩組分別為4.4%和3.8%,兩組分別有15.4%和9.8%的患者因不良反應導致治療終止。
GEMSTONE-301研究則探索的是給予同步/續貫放化療後,未進展的患者給予2年的PD-L1抑制劑——舒格力單抗的療效及安全性。資料公佈時,兩組中位PFS分別為9.0個月和5.8個月,HR=0.64;其中,接受同步放化療的患者,兩組中位PFS分別為10.51個月和6.37個月,HR=0.66,而接受續貫放化療的患者,兩組中位PFS分別為8.0個月和4.07個月,HR=0.59。兩組中位OS尚不成熟,3度及以上治療相關不良反應發生率分別為9%和6%,其中,最常見的分別為肺炎/放射性肺炎,發生率分別為3%和<%,治療相關的嚴重不良反應發生率分別為15%和10%。
二、兩項研究的比較
接下來,筆者將按照臨床研究設計中的PICOS原則,簡單介紹兩項研究的差異:
P(Participant,研究物件):兩項研究相同的一點是均不對PD-L1表達水平做要求,哪怕PD-L1表達水平未知也均可以入組(這一點為兩項研究結果的解讀帶來困難,稍後詳細說明);而兩項研究最大的不同體現在兩方面,GEMSTONE-301研究均為中國人群,且不允許驅動突變的患者入組;而PACIFIC研究以高加索人群為主,攜帶EGFR或者ALK融合的患者允許入組(為何這樣做,稍後解釋)。
I(Intervention,干預):兩項研究給予的干預均是針對PD-L1的免疫檢查點抑制劑,且在入組前均需要接受至少2周化療,具體化療方案也相似,包括紫杉醇、培美曲塞、長春瑞濱及依託泊苷等。但是,干預措施有幾點不同:GEMSTONE-301研究給予24個月的治療,而PACIFIC研究給予1年的治療;具體治療劑量而言,GEMSTONE-301研究中的舒格力單抗給予固定劑量1200mg治療,而PACIFIC研究中,度伐利尤單抗為10mg/kg,而不是參照1500mg的固定劑量;治療週期而言,舒格力單抗每3週一次,而度伐利尤單抗為每2週一次。
C(Control,對照):兩項研究一致,均以安慰劑作為對照。
O(Outcome,結局):GEMSTONE-301研究的主要研究終點為獨立評審委員會基於ITT人群評估的PFS;而PACIFIC研究則是雙終點設計,分別是獨立評審委員會評估的PFS及OS。
S(Study Design,研究設計):考慮到對照組是安慰劑,因此,兩項研究均是以2:1進行分組。而兩項研究之間最大的區別在於GEMSTONE-301研究允許接受序貫治療的患者入組,但是上限不允許超過40%,而PAFICIF研究則僅僅入組同步放化療接受後未進展的患者;此外,GEMSTONE-301研究基於PS評分、放化療聯合的形式及放療劑量(以60Gy作為分界)作為分層因素;而PAFICIF研究則是基於年齡、性別及吸菸狀態進行分層。
其他差異:此外,兩項研究在很多重要的基線變數,包括分期(GEMSTONE-301研究中,IIIa-IIIc期的比例分別為29%、57%和13%;PACIFIC研究中,未入組IIIc期患者,IIIa和IIIb期患者的入組比例分別為52.9%和44.5%)、組織病理型別(GEMSTONE-301研究中最常見的型別為鱗癌,佔比為69%,而PACIFIC研究中最常見的型別為非鱗癌,佔比為52.9%)。兩組詳細基線資料如下:
三、為何PFS差異巨大
重點來了。為何兩項研究的PFS差異如此巨大?GEMSTONE-301研究和PACIFIC研究中,兩組中位PFS分別為16.8個月和9.0個月,可能有讀者會覺得,因為GEMSTONE-301研究納入了序貫放化療的患者,這部分患者入組較快且療效相對同步放化療的患者更差,但是,當我們把GEMSTONE-301研究中,接受同步放化療的患者單獨拿出來,中位PFS與全人群基本一致,為10.51個月,與16.8個月仍然具有一定的差異。
筆者認為,造成這一差異的原因主要是三方面:其一是PD-L1表達水平的差異,其二是評估方式的差異,其三是基線特點的差異。
在PACIFIC研究的亞組分析中,PD-L1<1%的患者是不獲益的,這也是為什麼在歐洲,度伐利尤單抗在這部分患者中並未獲得相關的適應症,因此,在這兩項研究中,PD-L1<1%的患者佔比非常重要,而就是這樣一個非常重要的資料,卻發生了嚴重的缺失,因為兩項研究均不對PD-L1表達水平做強制檢測,這直接導致了在GEMSTONE-301研究和PACIFIC研究中,分別有52%和37%的患者PD-L1表達狀態不明,這對研究結果的解讀造成了困難;此外,研究的評估形式同樣可能造成了結果的差異。兩項研究的主要研究終點均為PFS,此時的終點事件包括兩類:疾病進展及患者死亡。後者好理解,但前者卻存在一定的不確定性。針對區域性晚期的患者,在完成放療或化療後,如果想要入組,疾病不能出現進展,這就意味著此時,患者不可能出現遠處轉移,此時,後續如何隨訪就成了關鍵。在臨床試驗中,對於骨、腦及其他非靶病灶所在器官,有些方案要求每次評估均要進行檢查,以確認疾病狀態,這種情況下出現疾病進展可以及時發現,對於PFS的評估相對準確,但是,過於頻繁的檢查可能會對患者造成傷害;另一種方式就是針對腦、骨等部位,設定一個較長的檢查週期(如,每年評估一次),期間,患者出現新發症狀且有研究者評估有必要後才會安排相關檢查,這種情況下,症狀的出現必然晚於實際進展的時間,此時對於PFS的評估可能相對樂觀,在PACIFIC研究的完整方案中,後續隨訪每個週期均採用CT/MRI進行評估,但是對於骨等非靶病灶的評估,並未詳細說明(完整研究方案第83頁);而在GEMSTONE-301研究中,筆者為並未看到詳細的檢查方法的選擇。
此外,由於兩項研究在重要基線特點、治療週期、研究設計等方面均存在眾多區別,因此,在忽視這些區別就直接基於簡單的中位PFS數值,得出某個治療更優或者更差的結論似乎是不妥當的,尤其是兩款藥物針對的是同一個靶點,並無孰優孰劣的理論依據的前提下,得出這種結論更應當慎重。
PS:文章內容僅供學術交流,並不構成對任何藥物的推薦或反對。