由北京市希思科臨床腫瘤學研究基金會、杭州東方臨床腫瘤研究中心與中國醫藥創新促進會抗腫瘤藥物臨床研究專業委員會共同主辦的“2021抗腫瘤新藥研究及腫瘤治療年終大盤點”於2022年1月25日在上海以線上線下相結合的形式召開。本次會議上,華中科技大學協和醫院腫瘤中心楊坤禹教授對頭頸鱗癌和鼻咽癌臨床研究進展進行了回顧和總結,醫脈通將重點內容整理如下。
專家簡介
- 三級教授/主任醫師 博士生導師
- 華中科技大學協和醫院腫瘤科主任/腫瘤病學教研室主任
- 中國臨床腫瘤學會(CSCO)鼻咽癌專委會副主委
- 中國臨床腫瘤學會(CSCO)放療專委會常委
- 中國臨床腫瘤學會(CSCO)頭頸腫瘤專委會常委
- 中國抗癌協會腫瘤放射治療專委會委員
- 湖北省抗癌協會常務理事
頭頸鱗癌臨床研究進展
區域性晚期頭頸鱗癌
免疫單藥
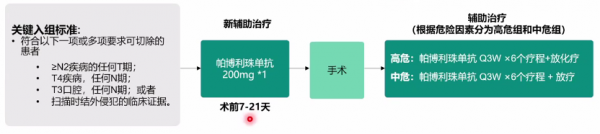
UCCI-HN-15-01研究(NCT02641093)是一項在可切除性的區域性晚期頭頸鱗癌患者(臨床分期T3/4和/或≥2個淋巴結轉移)手術前後給予帕博利珠單抗聯合放療±順鉑治療的臨床研究。主要研究終點為1年無復發生存(DFS)率。
研究共入組92例患者,76例可評估療效。中位隨訪24.4個月,中危組達到研究終點。此外,該研究顯示病理緩解深度與DFS、總生存期(OS)密切相關,帕博利珠單抗新輔助治療的病理緩解深度與PD-L1表達密切相關。病理緩解深度有望成為長期臨床獲益的替代指標。
既往報道,在可手術切除的HPV陰性Ⅲ/Ⅳ期頭頸鱗癌患者中使用1個週期的帕博利珠單抗新輔助治療,切除床中的病理學腫瘤緩解≥10%(pTR-any)和≥50%(pTR-2)的比例分別為44%和22%(pTR定義為腫瘤細胞壞死及伴有鉅細胞/組織細胞反應的角化碎片)。那麼,2個週期帕博利珠單抗新輔助治療是否能增加pTR ?
NCT02296684研究是一項多中心II期臨床試驗,HPV陰性局晚期頭頸鱗癌患者在手術前接受了2個週期帕博利珠單抗(200 mg)治療(術前42天和21天)。由兩名獨立的病理學家對切除床(原發腫瘤和/或淋巴結)的pTR進行分析,主要終點為pTR-2率以及1年的區域性復發或遠期轉移率。研究共納入29例患者,28例患者可進行主要終點評估,pTR-2率為42.9%(12/28例),並且安全性良好,未發生延遲患者手術,需要進一步研究來確定達到pTR的最佳劑量/時間與臨床結局的相關性。
雙藥免疫
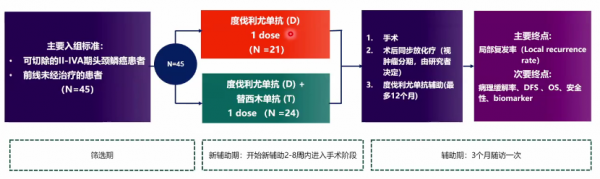
2021年ESMO大會上釋出了一項術前使用度伐利尤單抗(D)±Tremelimumab(T)新輔助治療可切除頭頸部鱗癌的研究結果。研究主要終點為區域性複發率,次要終點包括病理緩解率、DFS、OS及安全性。
結果顯示,D+T聯合組與D單藥組客觀緩解率(ORR)相近,分別為29.1%和33.3%。HPV陽性患者ORR有增加趨勢,ORR為40%(HPV陰性為24%)。腫瘤退縮方面,總人群中,達到50%以上退縮患者為17.8%(D:19.0%,D+T:16.7%),10%-49%退縮患者佔75.6%(D:81.0%,D+T:70.8%)。臨床降期分析中,31.1%患者成功降期,D+T組降期患者高於D單藥組(D+T:37.5%,D:23.8%)。在無區域性復發生存率(LRFS)方面,相比D+T,D組LRFS更高。在DFS率和OS方面兩組無顯著差別。
總體來看,術前使用度伐利尤單抗±Tremelimumab新輔助治療是安全可行的。單次D±T未出現手術延遲。影像緩解率單藥組是33.3%,雙藥組是29.1%,無明顯差別。而在雙藥組臨床降期率高於單藥組。後續研究者正在對免疫相關生物標誌物進行監測。
免疫+化療
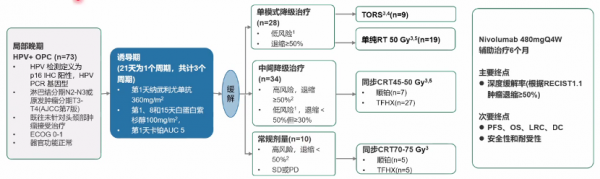
OPTIMA II期研究評估了納武利尤單抗聯合紫杉醇+卡鉑用於區域性晚期HPV相關口咽癌,並根據風險/緩解率適應性降階區域性區域治療的療效和安全性。
研究共納入73例患者,主要研究終點為深度緩解率(DDR)。中位隨訪時間為23.1個月,DDR達到了70.1%,2年PFS率為90.4%,2年OS率為93.3%,長期獲益顯著。該研究結果表明,免疫聯合化療降階策略頗具前景,值得進行後續隨機對照試驗。
CheckRad-CD8研究是一項前瞻性多中心II期研究,旨在評估度伐利尤單抗+ Tremelimumab+多西他賽/順鉑誘導治療區域性晚期頭頸鱗癌的療效和安全性。
中位隨訪時間為12.5個月,41例(52%)患者達到病理學完全緩解(pCR),31例患者腫瘤內CD8+免疫細胞增加。在進入放射免疫治療的60例患者中,直至第6週期有82%患者行免疫治療,達到主要終點80%。放射免疫治療佇列的1年PFS率為79%,1年OS率為89%。
該研究表明,度伐利尤單抗+Tremelimumab+多西他賽/順鉑誘導治療區域性晚期頭頸鱗癌是有效可行的治療方案,可提高患者的pCR率及腫瘤內的免疫效應細胞。誘導治療後基於CD8+T細胞的病理學結果有望成為後續治療方案及預後判斷的參考指標。
免疫+放療
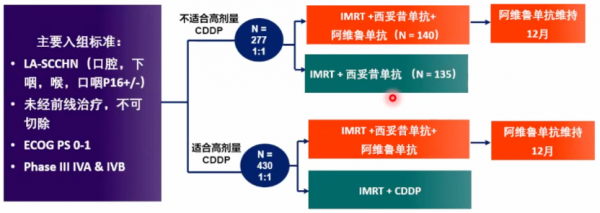
2021年ESMO大會上釋出的GORTEC-REACH研究旨在比較區域性晚期頭頸部鱗癌患者接受標準治療(SOC)方案與PD-L1(Avelumab)+SOC聯合治療方案的療效。
研究共納入707例患者,中位隨訪21個月,主要終點為PFS。對於順鉑耐受患者,試驗組和SOC-順鉑組相比,1年PFS率(95%CI)分別為64%(54%-72%) vs 73%(65%-81%),HR 1.27(95%CI 0.83-1.93)。對於順鉑不耐受患者,試驗組和西妥昔單抗標準治療組(Cetuximab-SOC)2年PFS率分別為44%(35%-53%) vs 31%(23%-40%)(HR 0.85,P=0.15),有獲益趨勢;試驗組和Cetuximab-SOC的2年區域性區域進展分別為34%(26%-43%) vs 44%(35%-53%)(HR 0.83,P=0.34);試驗組遠處轉移率較低(HR=0.31,P=0.007);試驗組和Cetuximab-SOC的2年OS率分別為58%(48%-67%) vs 54%(44%-64%)(HR 1.08,P=0.69)。
該研究表明,對於順鉑耐受患者,SOC方案更有利;順鉑不耐受的區域性晚期頭頸部鱗癌患者,接受放療+西妥昔單抗+PD-L1單抗治療,可延長PFS,降低遠處轉移和區域性進展的風險。
免疫輔助
2021年ASCO大會上公佈的一項單臂、II期研究(NCT03355560),目的是探索既往接受過根治性放療±化療的區域性復發頭頸鱗癌患者,行挽救性切除術後使用納武利尤單抗輔助治療的安全性和有效性。
研究結果顯示,2年DFS為60%(95%CI 0.39-0.91)。2年OS率為74%(95% CI 0.54-1)。高危患者相較無風險因素患者並未體現DFS和OS的差距,但由於兩組納入的患者都比較少,可能需要進一步研究驗證。
該研究顯示納武利尤單抗挽救術後輔助治療頭頸鱗癌患者,具有良好的耐受性和療效,2年 DFS率為60%,較歷史對照增加20%,挽救性手術後的免疫治療值得開展進一步隨機對照研究。
復發轉移頭頸鱗癌
雙藥免疫
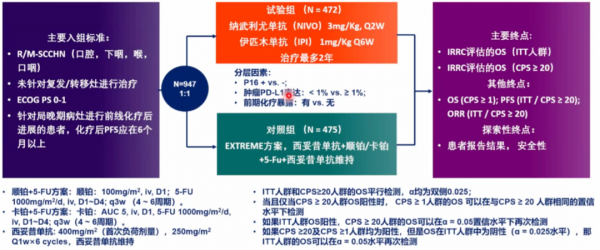
CheckMate 651研究旨在評估納武利尤單抗+伊匹木單抗(N+I)相較於EXTREME方案,對於適合鉑類治療的復發或轉移性頭頸部鱗癌患者一線治療的可能。
研究共納入947例患者,結果顯示,N+I組和EXTREME組在總人群中位OS分別為13.9個月 vs 13.5個月(HR 0.95,P=0.4951),CPS≥20人群中位OS:17.6個月 vs 14.6個月(HR 0.78,P=0.0469),總人群中未觀察到OS獲益。CPS≥1患者中,中位OS 分別為15.7個月 vs 13.2個月(HR 0.82,95%CI:0.69-0.97)。8%(N+I)和46%(EXTREME)的患者接受了後續免疫治療。分別有28%和71%的治療患者發生3-4級治療相關不良事件。
該研究表明,總人群及CPS≥20人群中,N+I相對於EXTREME方案,未顯示具有統計學意義的顯著OS改善;在CPS≥20和CPS≥1患者中存在一定臨床活性的證據,表現為OS延長和持久緩解。對照組的OS優於歷史資料。與EXTREME相比,N+I具有良好的安全性特徵,未觀察到新的安全性訊號。
免疫+靶向
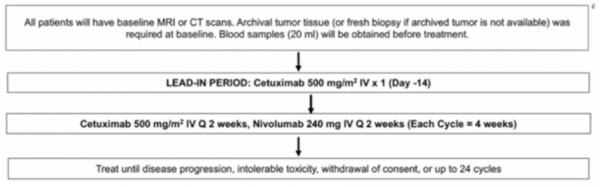
2021年ASCO大會上釋出了一項評估西妥昔單抗(CTX)和納武利尤單抗(NIVO)在未治療的復發轉移性頭頸部鱗狀細胞癌中的療效的研究。
該研究共分析了54個可評估的患者。中位年齡是62歲(42-85)。OS的中位隨訪時間為12.2個月。中位PFS和OS分別為7.8和14.5個月,而1年PFS率和1年OS率分別為39%和61%。基於腫瘤p16或PD-L1的狀態,PFS和OS均無統計學上的顯著差異。
該研究達到了1年OS的主要終點,將CTX聯合NIVO方案用於既往未經治療的復發轉移性頭頸部鱗狀細胞癌患者是安全有效的。
鼻咽癌臨床研究進展
區域性晚期鼻咽癌
輔助化療
《柳葉刀》線上刊載的馬駿教授團隊入選2021年ASCO大會口頭報告的一項III期臨床研究,探討了區域性晚期鼻咽癌患者接受根治性同步放化療後繼續接受卡培他濱節拍輔助化療的療效與安全性。
該研究共入組406例區域性晚期鼻咽癌患者,經過中位隨訪38個月,結果顯示達到主要終點無失敗生存率(FFS),卡培他濱節拍化療組和標準治療組的3年FFS率分別為85.3%和75.7%(95% CI 69.9-81.9);卡培他濱節拍化療組的疾病復發或死亡風險下降50%(HR 0.50,95% CI 0.32-0.79,P=0.002)。次要終點方面,卡培他濱節拍化療組和標準治療組的3年OS率分別為93.3%和88.6%,卡培他濱節拍化療組的死亡風險降低56%(HR 0.44,95% CI 0.22-0.88)。此外,卡培他濱節拍化療組的3年無遠處轉移生存率與LRFS均高於標準治療組。安全性方面,卡培他濱節拍化療組的多數不良事件為1級或2級,兩組均未報告嚴重不良事件。
該研究表明,將卡培他濱節拍化療作為區域性晚期鼻咽癌患者同步放化療後的輔助治療,可顯著改善患者生存獲益,且安全性良好,不影響患者生活質量。
復發轉移鼻咽癌
免疫+化療
中山大學腫瘤防治中心徐瑞華教授在2021年ASCO年會的全體大會上,彙報了JUPITER-02研究結果,即特瑞普利單抗聯合GP化療方案一線治療復發/轉移鼻咽癌的Ⅲ期隨機對照臨床試驗。
研究設計
該研究於2018年11月至2019年10月期間,從中國大陸、中國臺灣、新加坡的35家研究中心入組了289例患者,隨機分配至GP+特瑞普利單抗組(n=146)或GP+安慰劑組(n=143)。此次中期分析顯示達到了主要終點(由獨立中心評審的PFS,11.7 vs 8.0個月),相較於GP方案,GP+特瑞普利單抗可顯著降低48%的疾病進展和死亡風險(HR 0.52,95%CI 0.36-0.74,P=0.0003)。次要終點方面,由研究者評估的PFS也有顯著獲益(NE vs 8.0;HR 0.41,95%CI 0.28-0.59,P<0.0001);OS結果尚未成熟,但已顯示GP+特瑞普利單抗可降低40%的死亡風險(HR 0.60,95% CI 0.364-0.997,P=0.046);此外,GP+特瑞普利單抗的ORR、緩解持續時間(DoR)也有明顯改善。安全性方面,GP+特瑞普利單抗耐受性良好,未見新的安全性訊號。
JUPITER-02研究表明,在GP化療中加入特瑞普利單抗作為晚期鼻咽癌患者的一線治療,其PFS、ORR和DoR均優於單純GP化療,且安全可控。這些結果支援GP+特瑞普利單抗作為復發/轉移性鼻咽癌一線治療的新標準。
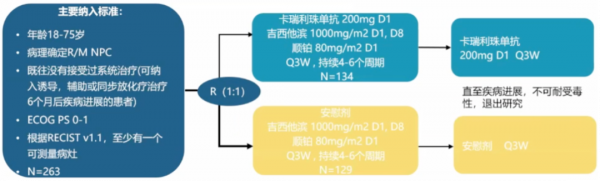
另一項III期CAPTAIN-1st研究旨在評估卡瑞利珠單抗聯合GP方案一線治療復發/轉移性鼻咽癌的效果。
卡瑞利珠單抗組的中位PFS為10.8個月,對照組為6.9個月;IRC評估卡瑞利珠單抗組的ORR為88.1%,對照組為80.6%;卡瑞利珠單抗組對比對照組的中位DoR為9.9個月 vs 5.7個月、疾病控制率(DCR)為96.3% vs 94.6%、18個月PFS率為34.8% vs 12.7%。
CAPTAIN-1st研究表明,卡瑞利珠單抗+GP 化療方案一線治療復發/轉移性鼻咽癌顯著延長了PFS,安全性可控。
免疫單藥
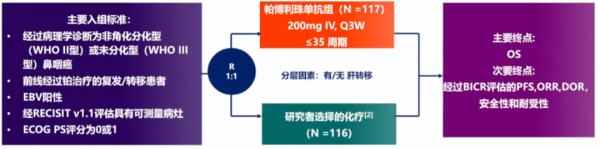
2021年ESMO大會公佈了一項隨機、對照 III 期KEYNOTE-122臨床研究,旨在評估帕博利珠單抗單藥對比化療用於鉑類經治復發/轉移性鼻咽癌的安全性和有效性。
試驗組中位 OS為17.2個月,對照組為15.3個月,兩組無顯著性差異(HR 0.9,95%CI 0.67-1.19,P=0.2262)。試驗組和對照組的PFS分別為4.1個月和5.5個月,ORR分別為21.4%和23.3%。
該研究表明,在含鉑方案治療失敗復發鼻咽癌患者中,對比化療,帕博利珠單抗單藥治療似乎並不能改善OS,也不能顯著提高PD-L1 CPS≥1患者的OS和ORR。與化療相比,帕博利珠單抗顯示出可控的安全性和較低的治療相關不良反應發生率。