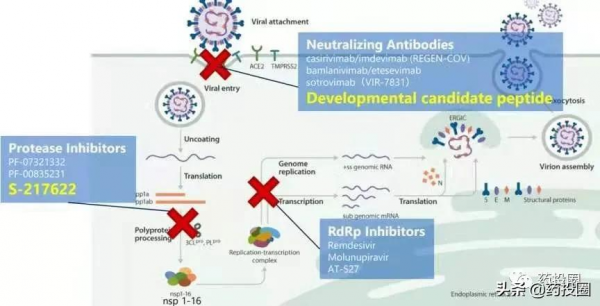
2月12日,NMPA附條件批准輝瑞口服新冠病毒治療藥物Paxlovid(奈瑪特韋片/利托那韋片組合包裝)在中國上市,為終結疫情帶來希望。
輝瑞年報中預測Paxlovid在2022年的銷售額高達220億美元,並分別與國內CDMO企業凱萊英和博騰股份簽訂了總價值超百億人民幣合同,其中,凱萊英合同金額約57億人民幣(兩次合同金額分別為27.20億元和48094萬美元),博騰股份合同金額為6.81 億美元。然而隨著同樣開發口服3CL蛋白酶抑制劑的企業不斷公佈資訊,Paxlovid面臨隱憂。
專利問題亟待解決
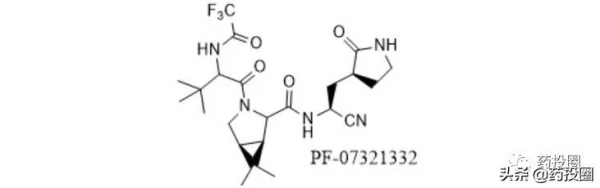
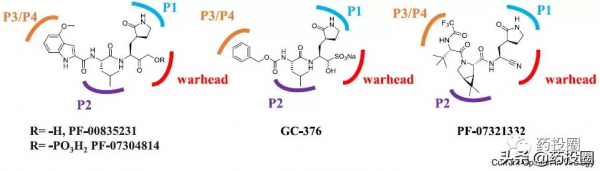
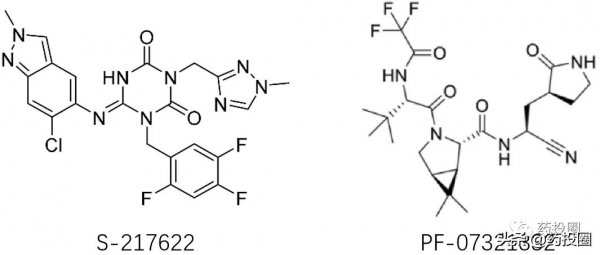
奈瑪特韋/nirmatrelvir(PF-07321332)的化學結構如下圖所示。
Pardes Biosciences申請了保護奈瑪特韋化學結構的美國專利US11124497,該專利在2020年4月申請優先權專利,2021年4月提交了正式專利申請,並於2021年9月獲得美國專利授權。
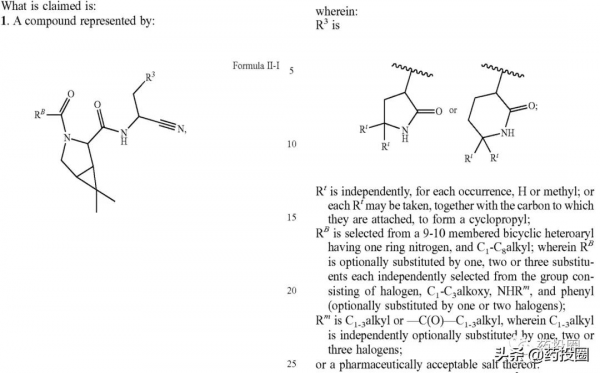
US11124497專利權力要求1如下所示:
當R3為
,Rt為H,RB為
且RB被NHRm取代,Rm為-COCF3時Formula II-I為PF-07321332的消旋結構,如下圖所示。
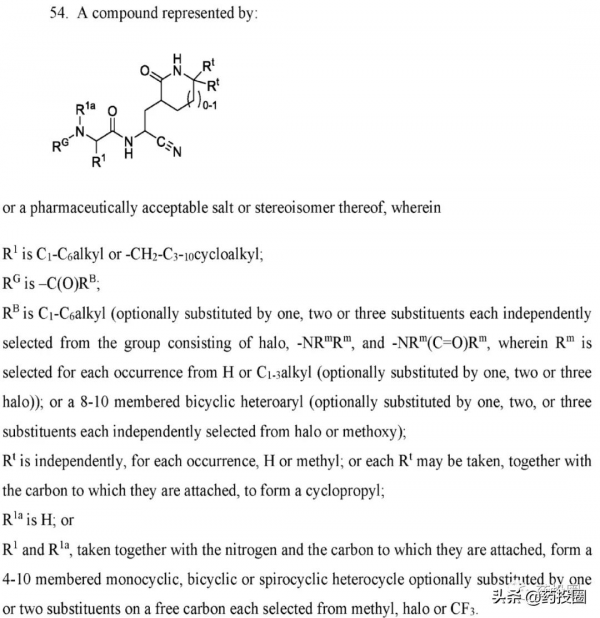
2021年12月16日,US11124497的PCT專利WO2021252644公開,其全文長達1588頁,WO2021252644權利要求中同樣涵蓋PF-07321332,尤其是第54項權利要求,內容與US11124497權利要求相似,可具體推匯出PF-07321332的結構,詳情如下。
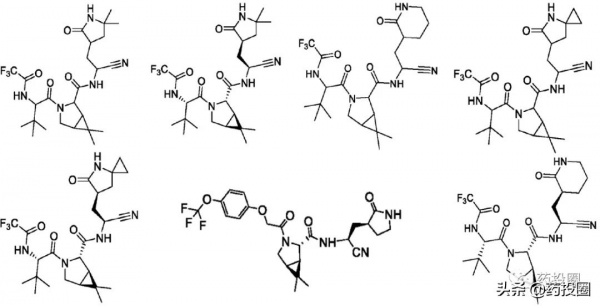
在實施例和權利要求中,WO2021252644公開了多個與PF-07321332結構類似的化合物,部分化合物結構如下所示。
WO2021252644的優先權日為2020年6月9日,公開日為2021年12月16日,輝瑞申請的PF-07321332化合物專利WO2021250648公開日與Pardes Biosciences的WO2021252644公開日相同,但優先權日卻比WO2021252644和US11124497晚,為2020年9月3日,晚於WO2021252644和US11124497。
即,申請同一化合物專利權,依據專利法第九條規定“同樣的發明創造只能授予一項專利權”,優先權在先的Pardes Biosciences將獲得授權,但因Pardes Biosciences專利中並未保護具體的PF-07321332化合物,輝瑞依舊有可能獲得單PF-07321332化合物的專利授權,然而,Pardes Biosciences的專利授權範圍會更廣,包含PF-07321332化合物,從而使輝瑞失去對PF-07321332的自由實施權利(FTO)。
通俗的說,就是輝瑞PF-07321332化合物專利有不被授權的可能,即使授權了也會受到Pardes Biosciences專利的限制,而不能隨便賣,賣了要賠償給Pardes Biosciences費用。
利托那韋——PF-07321332必須依靠的夥伴
PF-07321332為多肽衍生物,結構中含多個醯胺鍵,由於“首過效應”的影響,PF-07321332口服生物利用度低,其先導化合物PF-00835231大鼠口服生物利用度僅為1.4%。
即使進入血液P450酶對其代謝亦影響重大(血藥濃度迅速下降),PF-07321332在猴試驗中,口服生物利用度僅為8.5%,靜脈注射半衰期(t1/2)僅為0.79小時。
輝瑞PF-07321332的大鼠(圖A)、猴(圖B)、人體(圖C黑線)代謝試驗顯示,在不聯用利托那韋(RTV)的情況下,半衰期很短,聯用利托那韋(RTV)可有效克服這一缺陷(圖C紅線和圖D),造成P450酶抑制劑成為其必須依賴的夥伴。
利托那韋與很多藥物存在相互作用,主要有以下三個方面的原因:1)對CYP的影響。2)洛匹那韋可影響肝細胞對其它藥物的吸收和轉運,進而導致其它藥物血藥濃度改變。3)可以誘導這個葡萄糖醛酸化過程,影響其它藥物的代謝。
Paxlovid為奈瑪特韋(PF-07321332)片(兩片每片150 mg)與利托那韋片(一片100 mg)的組合包裝,受利托那韋藥理作用影響,PAXLOVID可改變其他藥物的血漿濃度,其他藥物也可能改變PAXLOVID的血漿濃度。考慮PAXLOVID治療前和治療期間發生藥物相互作用的可能性,需處方醫生審查PAXLOVID治療期間的合併用藥。
PBI-0451可能拋棄了利托那韋
PBI-0451為PardesBiosciences開發的口服3CL蛋白酶抑制劑,近日,PardesBiosciences公佈了PBI-0451的1期臨床試驗中期資料,顯示PBI-0451具備良好的耐受性和安全性。
同時,PBI-0451口服生物利用度高,與利托那韋無藥物相互作用,單劑量或多劑量給藥半衰期為4-6小時。
每日給藥兩次,每次給藥700mg(兩片每片350mg)可維持穩定、有效的血藥濃度。
臨床前資料顯示,PBI-0451小鼠和狗的口服生物利用度分別為39%和79%,遠高於輝瑞PF-07321332。
並且,與利托那韋或默沙東molnupiravir聯用對新冠病毒的抑制效果與PBI-0451單藥無顯著差異。
儘管PBI-0451結構尚未公佈,但從已公開資料推測,利托那韋已經被PBI-0451所拋棄。此外,PBI-0451的補充1期臨床臨床試驗申請已獲FDA批准(當前的1期臨床試驗在紐西蘭開展),預計將於2022年中期開展2/3期臨床試驗。
鹽野義已確定拋棄利托那韋
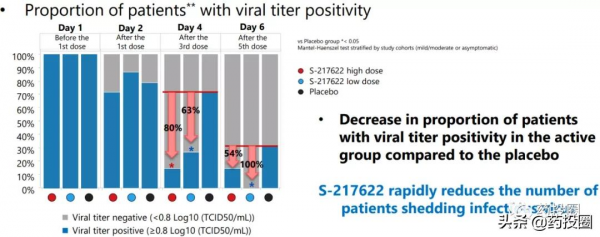
鹽野義也於近日公佈了旗下口服3CL蛋白酶抑制劑S-217622臨床2/3期試驗中2a期部分積極結果。
結果顯示,對比安慰劑,S-217622迅速降低病毒載量的效果得到證實;S-217622組患者病毒滴度陽性比例相比安慰劑組迅速下降;試驗中未觀察到高等級或嚴重不良反應。其中,給藥5次後,低劑量S-217622組患者病毒滴度陽性比例清零。
S-217622與輝瑞結構迥異,不含多肽結構。
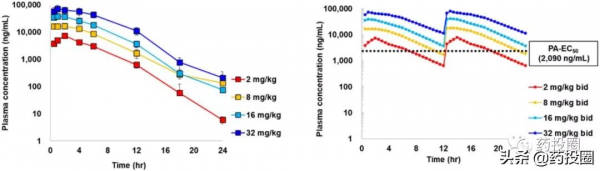
S-217622的小鼠代謝試驗顯示,儘管S-217622單藥代謝速度快於PF-07321332聯用利托那韋,但比PF-07321332單藥要慢的多,半衰期遠長於PF-07321332,故可實現單藥治療新冠,且療效顯著。下圖為S-217622小鼠模型試驗代謝圖。
S-217622經人肝微粒體(肝臟首過效應的主要起效物質)處理30分鐘後留存96%,大鼠體內半衰期為2.4小時,猴體內半衰期為10小時,狗體內半衰期為29.5小時,大鼠、猴、狗口服生物利用度分別為96.7%、106%、64.7%。
儘管與PF-07321332結構差異巨大,但S-217622對3CL蛋白酶的抑制作用卻並不遜色。
本次2a期臨床試驗前的小鼠模型試驗已驗證,感染新冠病毒後半天口服S-217622,12小時即起效。
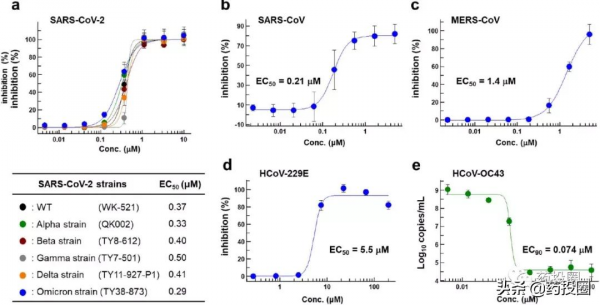
體外試驗顯示,S-217622對SARS-CoV-2、SARS、MERS、人冠狀病毒HCoV-229E等均有抑制活性,對新冠病毒的各種變異毒株均有效,對奧密克戎毒株的抑制活性略強。
與PF-07321332一樣,S-217622對於人體固有的蛋白酶,如胰凝乳蛋白酶(Chymotrypsin)等抑制活性遠小於對2019-nCoV等冠狀病毒的抑制活性。下圖為S-217622對數中人體固有的蛋白酶的體外抑制活性資料。
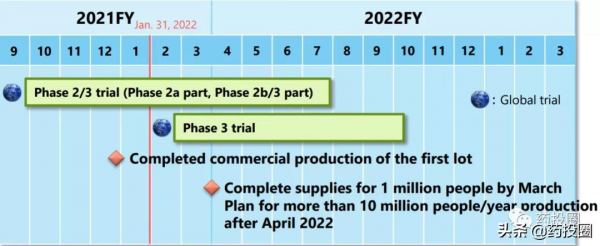
S-217622的首批商業化產品已於2021年12月完成生產,鹽野義預計2022年3月將完成100萬人份S-217622的生產,2022年4月後具備1000萬人/年的產能。
因3CL蛋白酶在冠狀病毒屬中高度保守,與S蛋白相比,非藥物誘導突變的自然突變不太可能發生,活性中心氨基酸與人類蛋白酶的同源性較低,大大降低了安全性問題等優勢是開發新冠治療藥物的理想靶點,輝瑞Paxlovid可將新冠肺炎非住院患者的住院或死亡率降低89%,是目前已上市療效最好的口服新冠治療藥物,加之口服藥物更是在儲存、運輸、分發方面的獨特優勢,讓Paxlovid被稱為全球新冠疫情的game changer,
輝瑞、鹽野義、Pardes Biosciences是目前全球開發口服3CL蛋白酶抑制劑進度最快的3家企業,鹽野義S-217622大機率即將上市,Pardes Biosciences的PBI-0451也將為期不遠,且二者大機率會將利托那韋拋棄,作為口服新冠治療藥物,擁有的前景更加廣泛。此外,輝瑞如不能妥善解決Pardes Biosciences的專利問題,無疑將付出巨大的代價。故,專利和利托那韋的問題有可能對Paxlovid的銷售額造成雙重打擊。