經治高危HER-2陽性早期乳腺癌中,T-DM1 vs 紫杉烷類及曲妥珠單抗,聯合帕妥珠單抗治療的III期臨床試驗
人表皮生長因子受體2(HER-2)陽性早期乳腺癌(EBC)的標準輔助治療方案是化療聯合抗HER-2靶向治療,但在治療療效和耐受性方面有其侷限性。曲妥珠單抗emtansine(T-DM1)是一種抗體-藥物偶聯物,由曲妥珠單抗和與之連線的細胞毒性藥物DM1組成,T-DM1的出現為該類乳腺癌患者治療帶來重大變革。近日一項發表在國際權威雜誌Journal of Clinical Oncology的文章表明,在接受手術或新輔助化療後的高危HER-2陽性乳腺癌患者中使用T-DM1聯合帕妥珠單抗治療替代紫杉烷+曲妥珠單抗+帕妥珠單抗聯合治療,顯示出與既往經驗一致的安全性,但未產生具有臨床意義的療效改善。該研究引發了有關HER-2陽性早期乳腺癌患者治療方案的進一步深思和探究。
研究背景
人表皮生長因子受體2(HER-2)陽性早期乳腺癌(EBC)的標準輔助治療方案是化療聯合1年抗HER-2靶向治療。高危人群(淋巴結陽性、腫瘤>2cm)中接受曲妥珠單抗治療的5年無病生存率為85%。既往APHINITY研究表明,與曲妥珠單抗單藥治療相比,帕妥珠單抗+曲妥珠單抗的雙重HER2靶向治療聯合輔助化療可改善意向治療(ITT)總人群的無侵襲性疾病生存期(IDFS)。這一結論在淋巴結陽性人群中得到確切體現:雙重靶向治療的6年IDFS為88%,相較之下,曲妥珠單抗的6年IDFS為83%。
除治療方案的選擇外,全身化療相關毒性是目前EBC治療面臨的另一大挑戰。紫杉烷類藥物可導致某些臨床表現明顯的毒性反應,如中性粒細胞減少、發熱性中性粒細胞減少、脫髮、神經病變、肌痛和關節痛等。
曲妥珠單抗 emtansine(T-DM1)是一種抗體-藥物偶聯物,由曲妥珠單抗和與之連線的細胞毒性藥物DM1組成。T-DM1既保留了曲妥珠單抗的HER2靶向定位功能,有可提供靶向遞送emtansine(MCC-DM1)作用。在發生癌症轉移的情況下,單藥T-DM1對曲妥珠單抗聯合紫杉烷方案耐藥患者有效,且為標準治療方案。
本研究旨在透過探究經蒽環類藥物治療後使用T-DM1替代紫杉烷+曲妥珠單抗來改善高復發風險、HER-2陽性EBC患者的療效並降低輔助化療的毒性。臨床前資料顯示帕妥珠單抗聯合T-DM1治療具有協同抗腫瘤活性。臨床資料顯示了聯合用藥的安全性和活性,即在癌症轉移和新輔助治療背景下,在曲妥珠單抗基礎上加用帕妥珠單抗可改善結局,因此該研究設計為每組均接受帕妥珠單抗。KAITLIN開展以來,既往MARIANNE試驗顯示出良好的臨床價值,該試驗在既往未經治療的轉移性乳腺癌中檢測T-DM1聯合帕妥珠單抗療效。與曲妥珠單抗+紫杉烷聯合帕妥珠單抗相比,T-DM1聯合帕妥珠單抗表現出相似療效,但其可耐受性未顯示優越之處。
研究方法
入組患者特徵
本試驗是一項在36個國家的288所研究中心進行的隨機、多國、開放標籤研究。
入組患者特徵包括新診斷、HER-2陽性、非轉移性、經組織學確診、可手術的原發性浸潤性乳腺癌患者。納入條件為淋巴結陽性疾病(pN≥1),區域性評估病理性腫瘤大小>2.0cm的淋巴結陰性疾病(pN0),雌激素受體(ER)和孕激素受體(PgR)陰性。
試驗設計
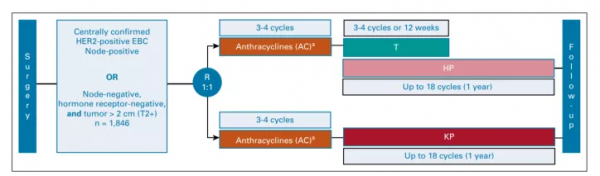
將擇期乳腺癌手術後9周內患者按1:1比例隨機分為試驗組和標準輔助治療組;實驗組接受以蒽環類藥物為基礎的化療聯合T-DM1+帕妥珠單抗 (AC-KP),標準輔助治療組接受以蒽環類聯合紫杉烷類+曲妥珠單抗+帕妥珠單抗(AC-THP)。
按地區(美國/加拿大、西歐/澳大利亞/紐西蘭、亞洲/世界其他地區)、淋巴結狀態(0、1-3或≥4陽性淋巴結)、激素受體狀態(ER/PgR陽性、ER和PgR均陰性)和蒽環類藥物型別(多柔比星/表柔比星)分層分析(圖1.試驗設計,圖2.研究物件納入流程)。
圖1.試驗設計
圖2.研究物件納入流程
給藥劑量及方式
T-DM1按照3.6 mg/kg給藥,3周/次。曲妥珠單抗先給予8 mg/kg負荷劑量,再按照6mg/kg給藥,3周/次。曲妥珠單抗與紫杉烷類同時開始給藥。帕妥珠單抗在給予840mg負荷劑量後按照420 mg/kg給藥,3周/次,T-DM1與曲妥珠單抗+紫杉烷同時給藥。從蒽環類藥物末次給藥至開始HER2靶向治療需要間隔3周。在曲妥珠單抗聯合紫杉烷治療後,繼續使用曲妥珠單抗+帕妥珠單抗治療需≥1年。在實驗組中,T-DM1聯合帕妥珠單抗持續使用≥1年。為了應對毒性反應,允許蒽環類藥物、紫杉烷、T-DM1延遲給藥或降低劑量;曲妥珠單抗和帕妥珠單抗僅允許延遲給藥。對於因毒性而停用T-DM1的患者,建議改用曲妥珠單抗以完成≥1年的抗HER2靶向治療。在紫杉烷化療結束時或HER2靶向治療期間T-DM1治療4個週期,根據臨床指徵給予輔助放療或激素治療。
研究終點
共同主要療效終點為淋巴結陽性亞群的IDFS和總人群的IDFS。次要療效終點為第二原發性非乳腺癌、無病生存期、無遠處復發間期和總生存期。
主要心臟事件終點包括重度心力衰竭和顯著左心射血分數(LVEF)下降或心源性死亡。次要心臟事件終點為症狀性左心室收縮功能不全伴顯著LVEF下降和無症狀性左室收縮功能不全(LVSD)。
患者報告結局(PRO)包括歐洲癌症研究和治療組織(EORTC)生活質量問卷-核心30(QLQ-C30)和改良的EORTC乳腺癌模組(QLQ-BR23)。總體健康狀況/QOL出現具有臨床意義的惡化定義為基線評分降低≥10分。功能和症狀的惡化由最小重要差異(minimally important differences,MID)定義。
結果
概述
2014年1月至2015年6月期間,共入組1,846例患者(n=5918,AC-THP;n=5928,AC-KP)。其中,1,658例(89.8%)為淋巴結陽性亞群(n=5826,AC-THP;n=5832,AC-KP)。
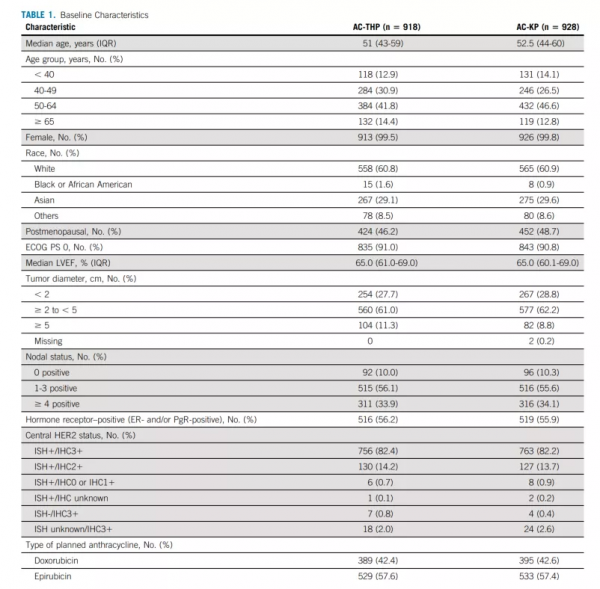
AC-THP組中位隨訪時間為57.1個月(52.1-60.1個月),AC-THP組為57.0個月(52.1-59.8個月)(表1.患者基線特徵)。
表1.患者基線特徵
療效
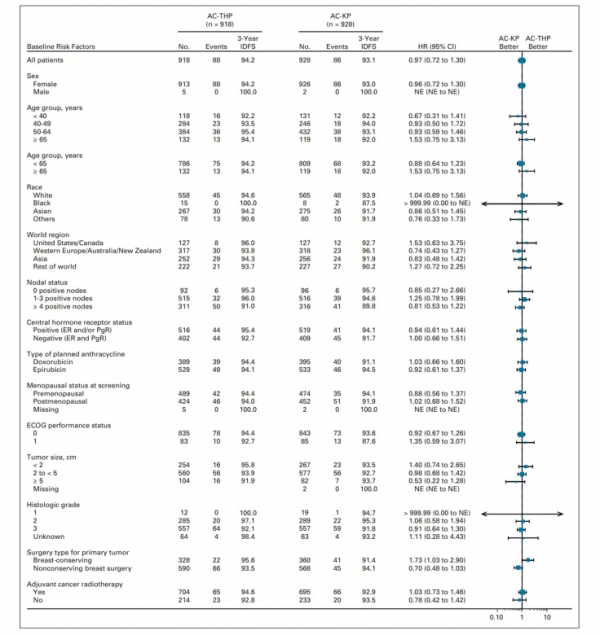
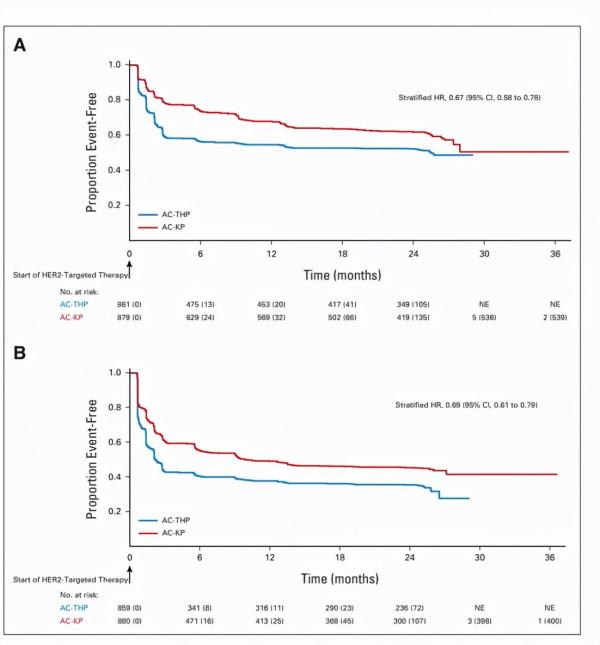
截至2019年11月,在ITT淋巴結陽性亞群中,AC-THP組和AC-KP組分別發生82例(9.9%)和80例(9.6%)IDFS事件。在淋巴結陽性亞群中,與AC-THP相比,AC-KP治療沒有降低IDFS事件的風險(分層HR=0.97;95%CI 0.71-1.32;P=5.83;圖3A.意向治療淋巴結陽性亞組人群中IDFS的Kaplan-Meier曲線)。在該亞組人群中,3年IDFS率為94.1%(95%CI 92.5-95.7),AC-KP組為92.8%(95%CI 91.0-94.5)。在ITT總人群中,AC-THP組和AC-KP組分別發生88例(9.6%)和86例(9.3%)IDFS事件。與AC-THP相比,AC-KP未降低IDFS事件的風險(分層HR=0.98;95%CI 0.72-1.32;圖3B. 總體人群中IDFS的Kaplan-Meier曲線)。AC-THP的三年IDFS發生率為94.2%(95%CI 92.7-95.8),AC-KP為93.1%(95%CI 91.4-94.7)。各組復發部位相似。在預設的探索性亞組分析中,除了在接受保乳手術亞組中AC-THP與AC-KP有一定優勢外,各亞組之間的IDF相似(圖4. IDFS的探索性亞組分析)。治療組之間的繼發性非原發性乳腺癌發生率、無病生存率和無遠處復發間隔相似。OS資料尚不成熟,接受AC-THP和AC-KP的患者的事件發生率分別為3.6%和4.7%。
圖3:IDFS的Kaplan-Meier曲線
A:意向治療淋巴結陽性亞組人群中IDFS的Kaplan-Meier曲線B:總體人群中IDFS的Kaplan-Meier曲線
圖4. IDFS的探索性亞組分析
不良事件
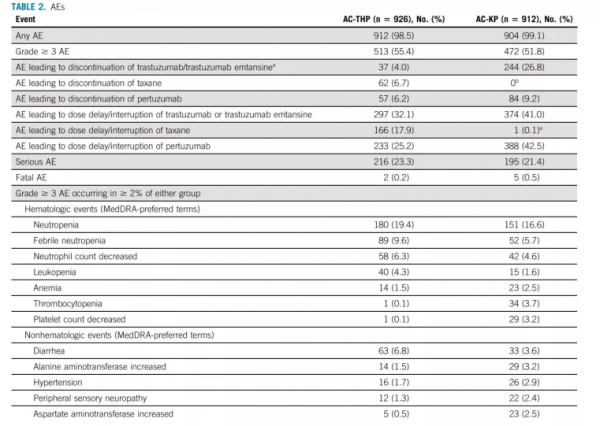
3級及以上不良事件和嚴重不良事件發生率在不同治療組之間相似(表2.不良事件統計)。
表2.不良事件統計
AC-THP組和AC-KP組中,分別有4.0%和26.8%患者出現導致曲妥珠單抗或T-DM1停藥的不良事件。AC-THP中6.7%患者出現導致紫杉烷停藥的不良事件。導致曲妥珠單抗停藥的最常見不良事件是射血分數降低(13例[1.4%])。導致T-DM1停藥的不良事件主要是實驗室異常(114例[47%]),最常見為膽紅素升高(49例[5.4%])和血小板計數下降(30例[3.3%])。與AE相關的死亡發生在兩名(0.2%)接受AC-THP治療的患者和五名(0.5%)接受AC-KP治療的患者。研究者不認為上述兩例死亡與研究治療有關。
在兩種治療方案中,接受AC-KP和AC-THP治療患者發生的最常見不良事件是任何級別的肝毒性(47.6%vs.15.6%)、任何級別的血小板減少症(32.3%vs.4.0%)和任何級別的出血(45.9%vs.25.9%)。除此之外,接受AC-KP和AC-THP治療患者任何級別肺毒性發生率分別為2.2%和3.3%,放射性肺炎發生率分別為1.4%和2.3%,原發性心臟事件發生率分別為1.1%和0.4%(均為未發生心臟死亡),而繼發性心臟事件發生率分別為5.7%和2.6%。
PRO
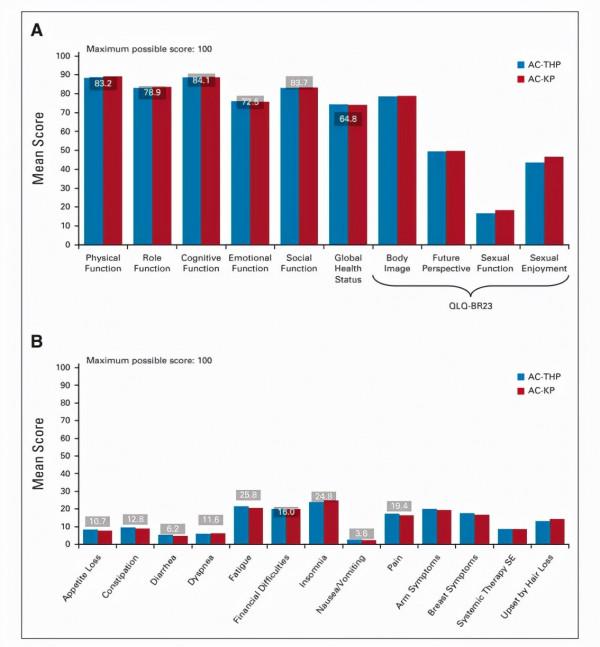
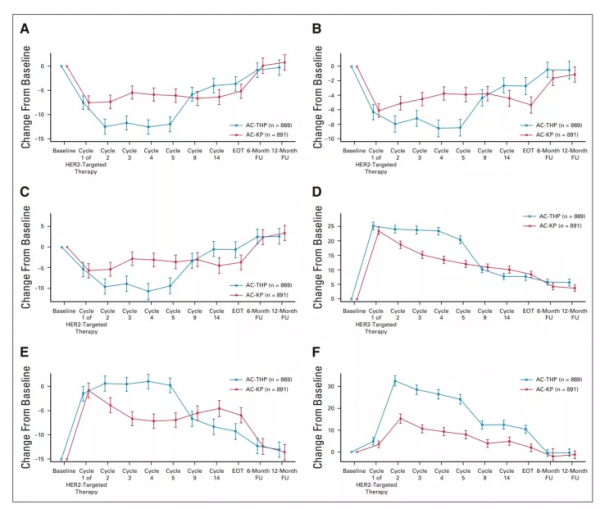
QLQ-C30和QLQ-BR23的基線評分反映了中至高水平的功能及總體QOL、低水平的疾病及治療相關症狀(圖5.基線QLQ-C30和QLQ-BR23)。在蒽環類藥物治療期間,各子量表和治療組的病情惡化模式一致(圖6. QOL較基線的平均變化)。
與預期相同,治療組之間QLQ-C30和QLQ-BR23功能量表以及QLQ-C30和QLQ-BR23症狀量表的校正平均評分相似,HER2靶向治療期的第1週期內,除組內症狀外(校正均值AC-THP,18.0;AC-KP,15.9;校正均值差異,-2.1[95%CI,–3.9至–0.3]),差異無臨床意義(圖7. QLQ-C30和QLQ-BR23的基線評分惡化的時間)。
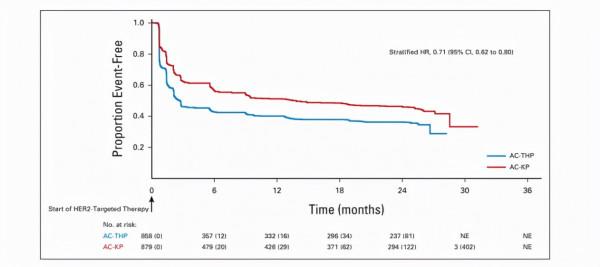
從HER2靶向治療開始,AC-KP組患者功能惡化停止,而AC-THP組患者在紫杉烷治療階段繼續惡化。當紫杉烷停藥時,AC-THP組功能改善,此後與AC-KP組相似。與AC-THP組相比,AC-KP組從HER2靶向治療開始出現具有臨床意義的總體健康狀況惡化,風險降低29%(分層HR,0.71;95%CI,0.62-0.80),大多數惡化發生在第一個HER2靶向治療週期期間(圖8. 從HER2靶向治療開始至功能惡化的時間)
圖5. 基線QLQ-C30和QLQ-BR23
A.功能量表評分 B.症狀量表評分
圖6. QOL較基線的平均變化
A.EORTC QLQ-C30總體健康/生活質量量 B.EORTC QLQ-C30身體功能量表 C.EORTC QLQ-C30角色功能量表 D.EORTC QLQ-BR23系統治療副作用量表 E.EORTC QLQ-C30疲勞量表 F.EORTC QLQ-C30腹瀉量表
圖7. QLQ-C30和QLQ-BR23的基線評分惡化的時間
圖8. 從HER2靶向治療開始至功能惡化的時間
A.從治療開始至身體功能惡化的時間 B.從治療開始至角色功能惡化的時間
討論
在淋巴結陽性亞群或高危EBC患者總人群中,與AC-THP相比, AC-KP未引起IDFS出現具有統計學意義或臨床意義的改善。AC-KP和AC-THP的安全性特徵與既往經驗一致。AC-KP組的QOL惡化風險較低,可能是AC-THP組的紫杉烷類所致,原因是在完成紫杉烷治療後,QOL恢復到與AC-KP組相當的水平。
值得注意的是,自本研究開展以來,EBC的治療方法發生了變化。基於KATHERINE試驗結果,目前推薦的高危HER-2陽性疾病的新輔助策略,即術後有殘留病變的患者接受T-DM1。在KATHERINE研究中,在含紫杉烷-曲妥珠單抗方案治療後的殘留侵襲性病灶患者中,輔助T-DM1優於曲妥珠單抗。KATHERINE資料暗示,有一部分癌症對紫杉烷-曲妥珠單抗至少部分耐藥,但對T-DM1保留敏感性。然而,本試驗觀察結果表明,用T-DM1替代紫杉烷-曲妥珠單抗並不能改善結局,也有一部分癌症對T-DM1+帕妥珠單抗耐藥,紫杉烷聯合曲妥珠單抗+帕妥珠單抗治療對其很重要。本研究中試圖探究並闡釋相關生物標誌物,以識別對T-DM1或紫杉烷選擇性敏感的癌症患者。
本試驗中,AC-KP與AC-THP相比,療效未得到改善,這與KRISTINE、MARIANNE 兩項深入研究結果一致,認為KP應作為位於化療之後的保留方案。兩者均未能證明KP優於以紫杉烷聯合曲妥珠單抗+帕妥珠單抗為基礎的方案,尤其是在HER-2表達較低和HER-2異質性較高的患者中。本試驗結果與其他研究一致,即細胞毒性藥物的長期使用對EBC無益。
總之,本研究和近期其他HER-2靶向治療研究結果支援目前定製的高危HER2陽性乳腺癌的管理方法:新輔助化療和曲妥珠單抗+帕妥珠單抗的初始治療,並在有殘留病變的患者中輔助T-DM1劑量遞增治療。鑑於在HER2陽性EBC研究中觀察到的有利結果,正在進行的研究現在集中於在大多數患者中使用曲妥珠單抗+帕妥珠單抗維持最佳HER2靶向治療療效的同時降低化療劑量的策略(Com-passHER2-pCR和Decrescendo),和僅對少數儘管接受最大限度當前管理但仍有復發風險的患者進行遞增治療(CompassHER2RD和DESTINY-Breast05)。
參考文獻:
Krop IE, Im SA, Barrios C,et al. Trastuzumab Emtansine Plus Pertuzumab Versus Taxane Plus Trastuzumab Plus Pertuzumab After Anthracycline for High-Risk Human Epidermal Growth Factor Receptor 2-Positive Early Breast Cancer: The Phase III KAITLIN Study. J Clin Oncol. 2021 Dec 10:JCO2100896.