磁珠法純化DNA主要是利用利息交換吸附材料吸附核酸,從而將核酸和蛋白質等其細胞中其他物質分離。本文主要概述了核酸分離與純化的原則、核酸分離與純化的步驟、磁珠法純化DNA原理。
核酸分離與純化的原則
核酸在細胞中總是與各種蛋白質結合在一起的。核酸的分離主要是指將核酸與蛋白質、多糖、脂肪等生物大分子物質分開。
在分離核酸時應遵循以下原則:保證核酸分子一級結構的完整性;排除其他分子汙染。
核酸分離與純化的步驟
大多數核酸分離與純化的方法一般都包括了細胞裂解、酶處理、核酸與其他生物大分子物質分離、核酸純化等幾個主要步驟。每一步驟又可由多種不同的方法單獨或聯合實現。
1. 細胞裂解:核酸必須從細胞或其他生物物質中釋放出來。細胞裂解可透過機械作用、化學作用、酶作用等方法實現。
(1) 機械作用:包括低滲裂解、超聲裂解、微波裂解、凍融裂解和顆粒破碎等物理裂解方法。這些方法用機械力使細胞破碎,但機械力也可引起核酸鏈的斷裂,因而不適用於高分子量長鏈核酸的分離。
(2) 化學作用:在一定pH環境和變性條件下,細胞破裂,蛋白質變性沉澱,核酸被釋放到水相。上述變性條件可透過加熱、加入表面活性劑(SDS、Triton X-100 等) 或強離子劑(異硫氰酸胍、鹽酸胍、肌酸胍) 而獲得。而pH環境則由加入的強鹼(NaOH)或緩衝液 ( TE、STE 等) 提供。在一定的pH環境下,表面活性劑或強離子劑可使細胞裂解、蛋白質和多糖沉澱,緩衝液中的一些金屬離子螯合劑(EDTA等)可螯合維持核酸酶活性所必須的金屬離子Mg2+ 、Ca2+ ,從而抑制核酸酶的活性,保護核酸不被降解。
(3) 酶作用:主要是透過加入溶菌酶或蛋白酶(蛋白酶K、植物蛋白酶或鏈酶蛋白酶)以使細胞破裂,核酸釋放。蛋白酶還能降解與核酸結合的蛋白質,促進核酸的分離。其中溶菌酶能催化細菌細胞壁的蛋白多糖N-乙醯葡糖胺和N-乙醯胞壁酸殘基間的β-(1 ,4) 鍵水解。蛋白酶K能催化水解多種多肽鍵,其在65 ℃及有EDTA、尿素(1~4mol/ L) 和去汙劑(0. 5 %SDS 或 1 %Triton X-100) 存在時仍保留酶活性,這有利於提高對高分子量核酸的提取效率。在實際工作中,酶作用、機械作用、化學作用經常聯合使用。具體選擇哪種或哪幾種方法可根據細胞型別、待分離的核酸型別及後續實驗目的來確定。
2. 酶處理:在核酸提取過程中,可透過加入適當的酶使不需要的物質降解,以利於核酸的分離與純化。如在裂解液中加入蛋白酶(蛋白酶K 或鏈酶蛋白酶) 可以降解蛋白質,滅活核酸酶(DNase 和RNase),DNase 和RNase 也用於去除不需要的核酸。
3. 核酸的分離與純化:核酸的高電荷磷酸骨架使其比蛋白質、多糖、脂肪等其他生物大分子物質更具親水性,根據它們理化性質的差異,用選擇性沉澱、層析、密度梯度離心等方法可將核酸分離、純化。
(1) 酚提取/沉澱法:核酸分離的一個經典方法是酚∶氯仿抽提法。細胞裂解後離心分離含核酸的水相,加入等體積的酚∶氯仿∶異戊醇(25 ∶24 ∶1 體積) 混合液。依據應用目的,兩相經漩渦振盪混勻(適用於分離小分子量核酸)或簡單顛倒混勻(適用於分離高分子量核酸)後離心分離。疏水性的蛋白質被分配至有機相,核酸則被留於上層水相。酚是一種有機溶劑,預先要用STE 緩衝液飽和,因未飽和的酚會吸收水相而帶走一部分核酸。酚也易氧化發黃,而氧化的酚可引起核酸鏈中磷酸二酯鍵斷裂或使核酸鏈交聯:故在製備酚飽和液時要加入82羥基喹嚀,以防止酚氧化。氯仿可去除脂肪,使更多蛋白質變性,從而提高提取效率。異戊醇則可減少操作過程中產生的氣泡。核酸鹽可被一些有機溶劑沉澱,透過沉澱可濃縮核酸,改變核酸溶解緩衝液的種類以及去除某些雜質分子。典型的例子是在酚、氯仿抽提後用乙醇沉澱,在含核酸的水相中加入pH5. 0~5.5,終濃度為0. 3M 的NaOAc 或KOAc 後,鈉離子會中和核酸磷酸骨架上的負電荷,在酸性環境中促進核酸的疏水復性。然後加入2~2.5 倍體積的乙醇,經一定時間的孵育,可使核酸有效地沉澱。其他的一些有機溶劑(異丙醇、聚乙二醇(等)和鹽類(10. 0mol/ L 醋酸銨、8. 0mol/ L 的氯化鋰、氯化鎂和低濃度的氯化鋅等)。不同的離子對一些酶有抑制作用或可影響核酸的沉澱和溶解,在實際使用時應予以選擇。經離心收集,核酸沉澱用70 %的乙醇漂洗以除去多餘的鹽分,即可獲得純化的核酸。
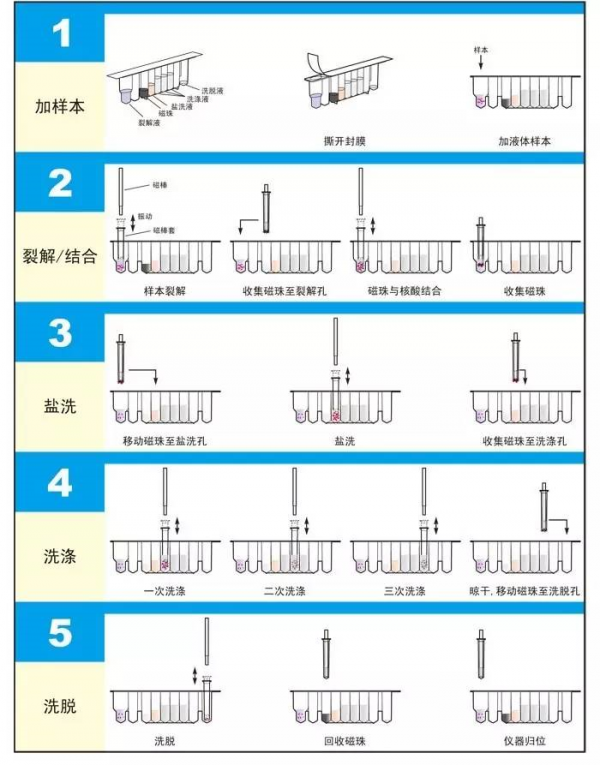
(2) 層析法:層析法是利用不同物質某些理化性質的差異而建立的分離分析方法。包括吸附層析、親和層析、離子交換層析等方法在內的層析法。因分離和純化同步進行,並且有商品試劑盒供應,而被廣泛應用於核酸的純化。在一定的離子環境下,核酸可被選擇性地吸附到矽土、矽膠或玻璃表面而與其他生物分子分離。另外一些選擇性吸附方法以經修飾或包被的磁珠作為固相載體,磁珠可透過磁場分離而無需離心,結合至固相載體的核酸可用低鹽緩衝液或水洗脫。該法分離純化核酸,具有質量好、產量高、成本低、快速、簡便、節省人力以及易於實現自動化等優點。
(3) 吸附法:玻璃粉或玻璃珠被證實為一種有效的核酸吸附劑。在高鹽溶液中,核酸可被吸附至玻璃基質上,離液鹽碘化鈉或高氯酸鈉可促進DNA 與玻璃基質的結合。在該方法中,細胞在鹼性環境下裂解,裂解液用醋酸鉀緩衝液中和後,直接加至含異丙醇的玻璃珠濾板,被異丙醇沉澱的質粒DNA 結合至玻璃珠,用80 %乙醇真空抽洗除去細胞殘片和蛋白質沉澱。最後用含RNase的TE緩衝液洗脫與玻璃珠結合的DNA,獲得的DNA可直接用於測序。
磁珠法純化DNA原理
磁珠法核酸純化技術採用了納米級磁珠微珠,這種磁珠微珠的表面標記了一種官能團,能同核酸發生吸附反應。
矽磁(Magnetic Silica Particle)就是指磁珠微珠表面包裹一層矽材料,來吸附核酸,其純化原理型別於玻璃奶的純化方式。
離心磁珠是指磁珠微珠表面包裹了一層可發生離心交換的材料(如DEAE,COOH)等,從而達到吸附核酸目的。不同性質的磁珠微珠所對應的純化原理是不一致。使用磁珠法來純化核酸的最大優點就是自動化。磁珠在磁場條件下可以發生聚集或分散,從而可徹底擺脫離心等所需的手工操作流程。
使用羧化磁珠同樣可以分離純化質粒DNA。該法在細胞裂解後,離心分離含質粒的水相,再加入羧化的磁粒,然後用 PEG/ NaCl 沉澱,使目的DNA 吸附至磁珠,,最後磁場分離被吸附的DNA,經乙醇洗滌,用TE洗脫,可獲得高產量的適用於毛細管測序的模板DNA。
Auto-Pure20核酸提取純化系統
Auto-Pure20核酸提取純化儀是透過使用磁珠法試劑提取純化核酸的裝置,具有自動化程度高,提取速度快,結果穩定,操作簡便等優點。可同時純化1-20個樣品,搭配不同種類的磁珠核酸試劑,可以快速提取動植物組織、血液、體液、刑事檢體等樣品中的DNA和RNA。廣泛應用於科研、疾控系統、食品安全、法醫、臨床監測等領域。
產品特點
顯示及控制軟體
-大螢幕顯示;觸屏式操作,簡單易用
-無需外接電腦;單機即可操作,節省空間
-將配置APP軟體,可透過安卓平板電腦,實時監控系統
溫度控制
-使用者可根據要求自定義裂解、洗脫溫度
程式設計功能
-強大的程式編輯功能;可滿足不同試劑要求
-可擴充套件乙太網遠端控制
快速提取及高純度、高得率、重複性好
-操作時間短,15~40min/次。每次可同時提取1~20份樣品
-根據試劑最佳化提純方案,提取的DNA/RNA純度高,實現了更高的提取效率
-避免人工操作引起的差異及錯誤,結果穩定,重複性好
-選擇優質耗材和工藝,磁珠損耗低,回收率高
汙染控制及消毒功能
-具有紫外消毒功能,減低不同批次間樣品的汙染
試劑開放
-開放系統, 可適用各種磁珠法提取試劑,並根據不同試劑最佳化提純方案,提取的核酸純度高
安全可靠
-抽屜式進樣,防止實驗人員受傷
-全自動執行、配備一次性耗材,避免接觸有毒物質
-智慧化操作,避免有害物質對人體的危害
-採用專利設計的9聯提取管,可單獨封裝,單獨上機進行核酸提取純化,減少試劑浪費,特--別適合科研單位使用
操作流程
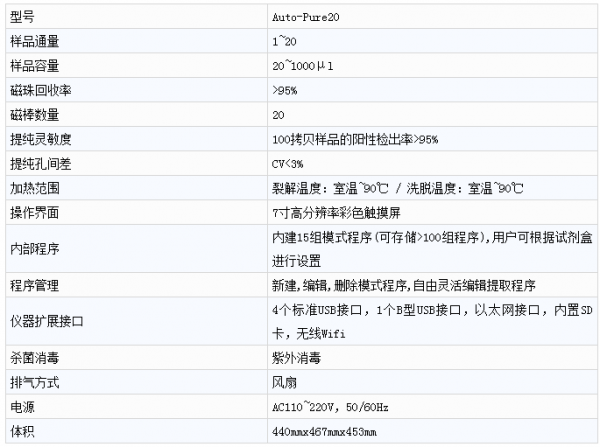
效能指標
注:還有Auto-Pure32可供選擇,可同時純化1-32個樣品,使用96孔深孔板試劑盒。