近日,Insight 資料庫顯示,翰森製藥的 GLP1R/GIPR 雙重激動劑 HS-20094 首次公示啟動臨床。該藥在 2021 年 7 月首次獲批臨床,同年 11 月即完成首例入組。

來自:Insight 資料庫(http://db.dxy.cn/v5/home/)
據 IDF 最新報告,2021 年全球糖尿病患者多達 5.37 億人。而 GLP-1R 激動劑類藥物正與胰島素二分天下,市場規模在 2020 年已經高達 124 億美元,且仍在高速增長。在 2021 年的全球藥品銷售額 Top20 中,GLP-1 類似物強勢佔據兩個席位,度拉糖肽(Trulicity)和司美格魯肽(Ozempic+Rybelsus)分別獲得了 64.72 億美元(+28%)和 58.57 億美元(+67%)收入。
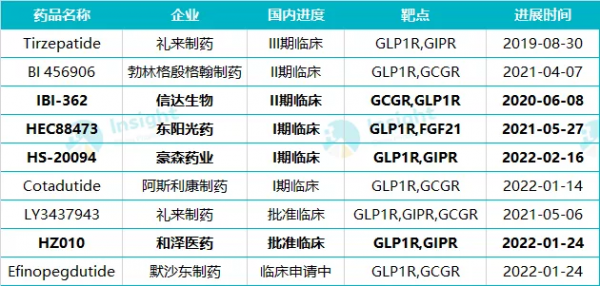
GLP-1 藥物群雄競逐,國內競爭也正在走向白熱化。而隨著積極臨床資料的釋出,下一代潛在的「爆款」降糖藥或將誕生在多靶點激動劑領域。放眼全球,禮來的 Tirzepatide 是其中的領先者,透過優先審評券提交上市申請,以期在 2022 上半年就以最快速度將其推向市場,充分體現了禮來對該專案的重視。而在中國,進入臨床階段的國產同類藥物當前僅 4 款,總體還處於研發早期。不過由於該領域醫藥交易持續活躍,預計 2022 年及之後有望迎來申報熱潮。
翰森製藥的 HS-20094 是國產第 3 款啟動臨床的雙靶點降糖藥。當前進展最快的是信達生物與禮來合作的 IBI362,這是一款 GLP-1R/GCGR 雙重激動劑,當前已經啟動了針對 2 型糖尿病和肥胖症的 2 期臨床,信達預計在 2022 年推進其關鍵註冊臨床;東陽光藥的 HEC88473(GLP-1R/FGF21)和翰森製藥的 HS-20094(GLP1R/GIPR)緊隨其後,都處於 I 期臨床,和澤醫藥也開發了 HZ010(GLP1R/GIPR),當前尚未啟動臨床。論及臨床前專案,恆瑞、華東醫藥、信立泰等企業均有相應自研或引進新藥。
雙靶點降糖藥國內研發申報情況
根據 Insight 資料庫,翰森製藥自 2021 年進入了新藥申報的爆發期,全年多達 14 款新藥專案首次申請臨床,以化藥為主,生物製品新藥也有 2 款申報。
翰森製藥近 5 年創新藥專案臨床申報情況
*僅統計首次申報

來自:Insight 資料庫(http://db.dxy.cn/v5/home/)
從治療領域看,除了 2 款最新申報專案尚未披露擬研發適應症,其他新藥以腫瘤適應症為主(7)。其中 8 個新藥已經啟動臨床試驗。
翰森製藥 2021 年申報臨床新藥
從臨床後期及申報上市新藥來看,引進自 Viela 的生物新藥 Inebilizumab 有望在 2022 上半年獲批上市。這是一款人源化 CD19 導向性單克隆抗體,也是國內首款報產的 CD19 單抗,用於治療抗水通道蛋白-4(AQP4)抗體陽性的視神經脊髓炎頻譜障礙(NMOSD)成人患者。如若獲批,這將成為翰森製藥第一款獲批上市的抗體藥。點此檢視審評進展
每月一次給藥的腎性貧血新藥培化西海馬肽在 2021 年 9 月申報上市,同樣有望在 2022 下半年或 2023 年獲批上市。除此之外,進展最快的是 HS-10342,這是一款處於 II 期臨床階段的 CDK4/6 抑制劑。