近日,中國科學院分子細胞科學卓越創新中心(生物化學與細胞生物學研究所)徐國良研究組和季紅斌研究組合作,以Loss of TET reprograms Wnt signaling through impaired demethylation to promote lung cancer development為題在PNAS上線上發表最新研究成果。透過對公共臨床資料的深入分析並結合一系列臨床前的自發成瘤小鼠模型,該研究揭示了DNA雙加氧酶TET家族蛋白調控肺上皮細胞癌變過程中DNA甲基化的動態平衡,維持肺腺癌(lung adenocarcinoma, LUAD)發生發展中關鍵致癌訊號通路Wnt signaling的拮抗基因的低甲基化及適當的表達,以確保Wnt signaling不被過度活化,進而抑制肺上皮細胞的癌前病變及肺腺癌的惡性進展。
徐國良團隊長期致力於TET雙加氧酶及其介導的DNA氧化去甲基化的分子機理及生物學功能研究(Xu et al., Nat Chem Biol, 2020)。TET酶能夠迭代氧化5-甲基胞嘧啶(5mC),依次產生5-羥甲基胞嘧啶(5hmC)、5-醛基胞嘧啶(5fC)和5-羧基胞嘧啶(5caC),而5caC能被DNA糖苷酶TDG特異識別並切除,隨後偶聯鹼基切除修復實現DNA主動去甲基化。基於這條DNA主動去甲基化通路,該研究團隊也深入探討了其在小鼠早期胚胎髮育、成體神經發生與認知、體細胞重程式設計及原腸運動中的生物學功能。
眾所周知,表觀遺傳的異常存在於各種型別的癌症中,並且表觀遺傳改變經常與遺傳改變協同作用驅動致癌表型,其中就包括DNA甲基化的失衡。鑑於TET家族基因在血液腫瘤中相對較高的突變頻率,絕大部分研究都關注TET酶在這類癌症中的作用。相比之下,由於突變頻率較低,TET酶在實體腫瘤中究竟發揮怎樣的作用?與血液系統腫瘤中的功能有何異同?TET基因的突變或TET酶的功能缺失是否會在實體腫瘤發生發展中賦予癌細胞選擇性的生長優勢?這些問題都還缺乏研究。
為了回答這些問題,研究人員分析發現TET基因在肺癌、腸癌及面板癌中的突變頻率較高。鑑於肺癌在全球範圍內的發病率和致死率居高不下,研究人員選擇將最主要的肺癌亞型肺腺癌作為研究物件。進一步分析顯示,TET基因在7.4%的肺腺癌中發生突變,與致癌驅動基因KRAS存在共突變關係,與EGFR突變則是互斥關係,且KRAS和TET共突變的病人生存期明顯縮短。此外,TET基因突變會導致其自身的表達和氧化酶活受損。伴隨著腫瘤發展,TET基因的表達水平也逐漸降低,且TET低表達的肺腺癌患者的生存期也相對較短。
研究人員構建了透過滴鼻誘導KrasG12D啟用及Tet基因敲除的自發成瘤小鼠模型,來模擬上述臨床特徵。有趣的是,致瘤表型分析顯示同時失活三個Tet基因劇烈加速了KrasG12D驅動的肺腺癌發生發展,而Tet基因單敲除或雜合敲除的結果表明Tet家族不同基因具有協同抑癌的作用,並且其抑癌效應主要依賴於氧化酶活。
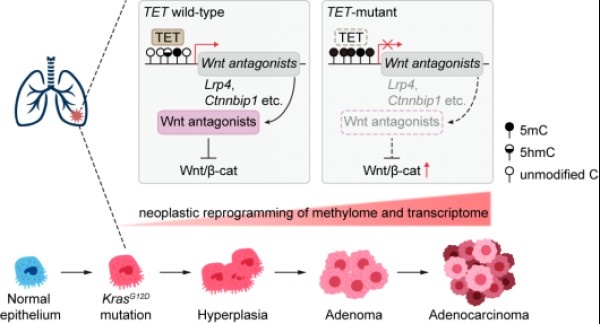
機制研究發現,Tet敲除誘發了惡性癌變前體細胞中DNA甲基化和轉錄的重程式設計,尤其表現為Wnt signaling異常上調,同時呈現出Wnt signaling相關基因的高甲基化。在KrasG12D; Tet三敲除的肺腺癌細胞系中的回補實驗顯示,TET氧化酶活的恢復介導了Wnt相關拮抗基因(Lrp4, Ctnnbip1, Dact1, Tmem88)的啟動子區域的氧化去甲基化,並重新激活了這些拮抗基因的表達,從而抑制了Wnt signaling過度活化。值得注意的是,這些小鼠模型中的發現也得到了臨床資料的進一步支援,在TET突變的肺腺癌樣本中WNT拮抗基因的高甲基化與其低表達相關。相應地,敲除Wnt signaling效應因子β-catenin,能夠大幅度緩解由Tet缺失引發的肺癌表型,印證了Wnt signaling是受到TET酶氧化酶活調控的下游靶通路。
綜上,該研究首次在實體腫瘤中建立了能夠真實模擬臨床的TET條件性敲除的自發肺腺癌小鼠模型,提供了Kras和Tet基因協同突變誘發惡性肺腺癌的遺傳學證據,闡明瞭肺腺癌發生發展中表觀遺傳層面的重要調控機理,為開發針對TET突變的肺腺癌患者靶向抑制Wnt signaling的治療方式奠定了理論基礎。
該研究工作得到國家重點研發計劃、國家自然科學基金、中科院戰略性先導科技專項、中科院基礎前沿科技專項、中科院國際合作專案等的經費支援。
【來源:上海市科委_科技縱覽】
宣告:此文版權歸原作者所有,若有來源錯誤或者侵犯您的合法權益,您可透過郵箱與我們取得聯絡,我們將及時進行處理。郵箱地址:[email protected]