急性髓系白血病(AML)的治療策略通常包括誘導治療和緩解後治療。據既往研究顯示,約70%的AML年輕成人患者在接受標準“3+7”誘導治療後,可達到形態學完全緩解(CR)。達到CR的患者通常接受緩解後治療以預防復發,緩解後治療方案通常為幾種鞏固化療方案聯合或不聯合造血幹細胞移植(HSCT)。目前AML患者緩解後治療方案的選擇取決於細胞遺傳學和分子標誌的危險分層。根據分子/細胞遺傳學危險分層體系,AML患者被分為低危、中危、高危三個組別。對於低危AML患者而言,首次緩解(CR1)後的治療方案通常為強化化療。但對於這類患者的緩解後治療方案的選擇仍然存在爭議,例如,既往有研究報道顯示,與強化化療相比,異基因造血幹細胞移植(allo-HSCT)和自體造血幹細胞移植(auto-HSCT)對伴有CEBPA雙突變的低危AML患者有更好的生存獲益。因此,對於低危AML患者而言,還需要考慮其他因素進而對低危AML患者進行更精細的治療分層。
越來越多的研究表明,持續存在可測量殘留病灶(MRD)的患者復發風險高、預後差,所以MRD對於緩解後治療方案的選擇是一個重要的考慮因素。但緩解後治療方案決策的最佳時間點仍無定論。基於此,南方醫科大學南方醫院劉啟發教授及其團隊回顧性分析了低危AML年輕成人患者CR1後動態監測MRD與緩解後治療方案對預後的影響。
研究方法
自2012年1月1日至2017年12月30日,研究者從華南血液專科聯盟資料庫連續篩選出642例新診斷的初治低危AML患者,最終納入了403例達到CR1的患者。低危AML的定義基於NCCN標準,包括NPM1突變、RUNX1-RUNX1T1、CBFB-MYH11和CEBPA雙突變。根據緩解後治療方案的不同,患者分為三組:化療組(CMT)、auto-HSCT組和allo-HSCT組。既往未進行HSCT且接受了至少兩個週期鞏固化療的患者納入CMT組;化療後復發且後續接受了HSCT的患者仍納入CMT組。納入標準:①14-60歲;②低危AML;③CR1。因為有FLT3-ITD等位基因比率檢測結果的患者較少,且FLT3-ITD突變患者尚未達到使用索拉非尼治療的共識,會有不可避免的偏倚,所以NPM1/FLT3-ITD突變的患者未被納入研究(n=85)。末次隨訪日期為2021年5月31日。主要終點為5年累積總生存(OS)率,次要終點包括累積無病生存(DFS)率、累積複發率(CIR)和非復發死亡率(NRM)以及無移植物抗宿主病且無復發生存率(GRFS)。
研究結果
1患者特徵
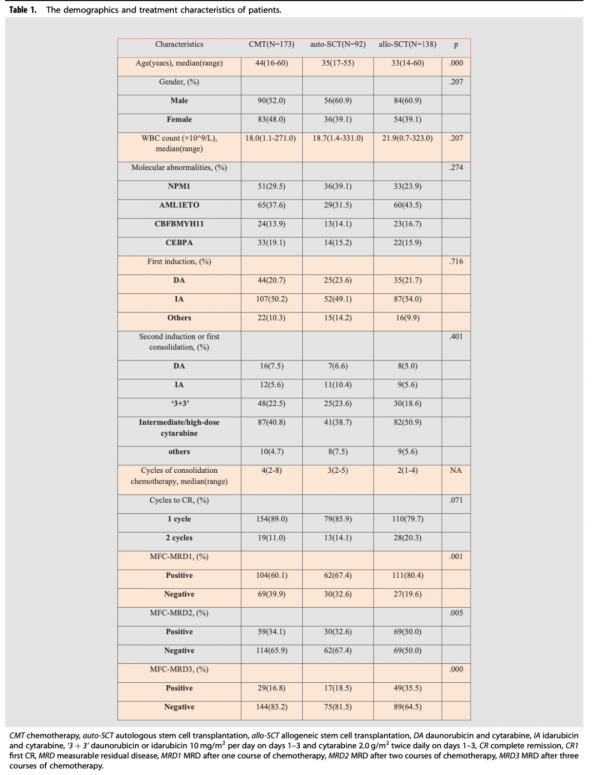
該研究共納入403例患者,CMT組173例,auto-HSCT組92例,allo-HSCT組138例。該研究中,MRD是原因變數,因此為確保MRD資料完整性,排除了在3個化療療程內77例MRD資料缺失的患者。在這77例患者中,CMT組40例(18.8%),auto-HSCT組14例(13.2%)以及allo-HSCT組23例(14.3%)(p=0.335),資料缺失率在三組之間無統計學差異。在allo-HSCT組,61例患者接受了匹配同胞供者(MSD)移植,77例接受了替代供者移植,在後者中,64例為單倍體供者(HID)移植,10例為匹配無關供者(MUD)移植以及3例為臍帶血移植。入組患者的中位年齡為36(14-60)歲,CMT組中位年齡為44(16-60)歲,auto-HSCT組為35(17-55)歲,allo-HSCT組33(14-60)歲。CMT組患者的年齡高於auto-HSCT和allo-HSCT組的患者,有統計學意義(p值分別為p=0.002和p<0.001)。與CMT組相比,在allo-HSCT組中,需要兩個週期才能達到CR的患者比例更高(p=0.026)。在allo-HSCT組中,第一次化療後MRD+(MRD1+)、第二次化療後MRD+(MRD2+)以及第三次化療後MRD+(MRD3+)的患者更多(p=0.001、p=0.006、p<0.001)。三組患者基本特徵具體如圖1。
2生存分析
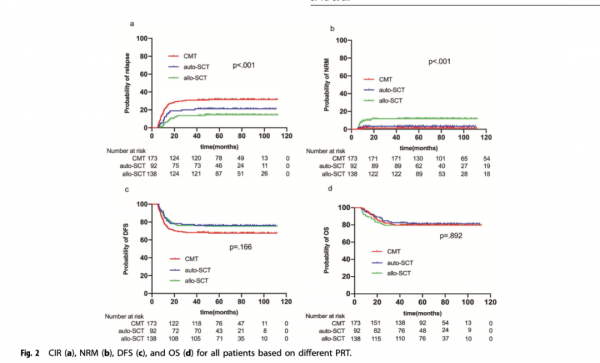
入組患者CR1至復發的中位時間為10.4(5.2-50.7)個月,CMT組為9.7(5.2-50.7)個月,auto-HSCT組為11.0(6.1-38.2)個月,allo-HSCT組為14.0(5.8-47.2)個月(p=0.018)。與CMT組相比,allo-HSCT組CR1至復發的時間更長,差異有統計學意義(p=0.006),但allo-HSCT與auto-HSCT(p=0.181)或auto-HSCT與CMT組(p=0.191)之間無統計學差異。CMT組的5年CIR為31.3%(95%CI,24.5-38.3%),auto-HSCT組為20.6%(95%CI,13.1-29.5%),allo-HSCT組為13.1%(95%CI,8.1-19.3%)(p<0.001)(圖2a)。多變數分析表明,allo-HSCT組的CIR顯著低於CMT組(HR,0.176[95%CI,0.096–0.324];p<0.001)和auto-HSCT組(HR,0.330[95%CI,0.170–0.639];p=0.001),且auto-HSCT組的CIR也低於CMT組(HR,0.535[95%CI,0.320–0.893];p=0.017)。5年累積NRM在CMT、auto-HSCT和allo-HSCT組分別為1.2%(95%CI,0.2-3.8%)、3.3%(95%CI,0.9-8.5%)和11.6%(95%CI,6.9-17.6%)(p<0.001)(圖2b)。allo-HSCT組的NRM顯著高於CMT組(HR,10.605[95%CI,2.449–45.923];p=0.002)和auto-HSCT組(HR,3.710[95%CI,1.080–12.744];p=0.037),但auto-HSCT和CMT組之間無統計學差異(HR,2.858[95%CI,0.478–17.090];p=0.250)(圖2b)。
CMT組的5年DFS率為67.5%(95%CI,60.0-74.0%),auto-HSCT組為76.1%(95%CI,66.0-83.6%),allo-HSCT組為75.3%(95%CI,67.2-81.7%)(p=0.166)(圖2c),在單變數分析中,3組的5年DFS率無統計學差異。但是,多變數分析表明allo-HSCT組(HR,0.372[95%CI,0.234–0.591];p<0.001)和auto-HSCT組(HR,0.595[95%CI,0.360–0.984];p=0.043)比CMT組有更好的DFS。3組5年OS率分別為79.8%(95%CI,73.0–85.0%)、81.3%(95%CI,71.7–88.0%)和79.7%(95%CI,72.0–85.5%)(p=0.892)(圖2d)。在單變數和多變數分析中,緩解後治療方案的選擇並不是OS的獨立影響因素。在多變數分析中,較高的白細胞計數(≥50×109/L)、兩個週期化療達到CR、MRD2+和MRD3+是DFS和OS的危險因素。
3動態監測MRD的亞組分析
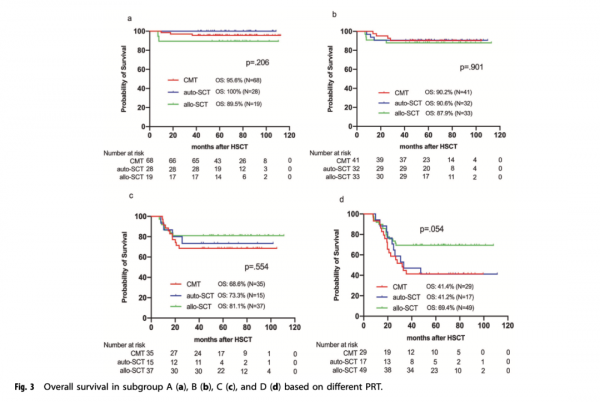
研究者為了探索透過多引數流式細胞儀(MFC)動態監測的MRD、緩解後治療方案選擇和低危AML臨床結局之間的關聯,根據MRD1、MRD2和MRD3的動態變化進行了亞組分析。患者分為四個亞組:(I)亞組A,1個療程化療後達到MRD-(MRD1-/MRD2-/MRD3-);(II)亞組B,2個療程化療後達到MRD-(MRD1+/MRD2-/MRD3−);(III)亞組C,3個療程化療後達到MRD-(MRD1+/MRD2+/MRD3−);(IV)亞組D,3療程化療後持續MRD+(MRD1+/MRD2+/MRD3+)或MRD復陽(從MRD-到MRD+)。在亞組A和亞組B中,CMT組、auto-HSCT組和allo-HSCT組患者的OS無統計學差異(p值分別為p=0.340和p=0.627)。但在兩個亞組中,CMT和auto-HSCT組患者的GRFS均優於allo-HSCT。在亞組C中,allo-HSCT組的DFS率優於CMT組(p=0.009)。在亞組A、B、C中,緩解後治療方案的選擇對OS並未有顯著影響。但在亞組D中,allo-HSCT組的OS優於CMT組和auto-HSCT組(p值分別為p=0.011和p=0.029)。具體如圖3。
研究結論
該研究首次嘗試根據動態監測MRD的結果,探索低危AML患者緩解後治療方案的最佳選擇。研究結果表明,對於3個化療週期內可以達到MRD-患者,推薦首次緩解後強化化療;對於3個化療週期持續MRD+或MRD復陽的患者,推薦接受allo-HSCT治療。該回顧性研究還是有一定缺陷,比如,有的偏倚無法避免;CMT和HSCT組之間患者年齡的不平衡;在亞組分析中,某些亞組的患者例數過少。總之,該研究還需要前瞻性臨床試驗的資料支援。
參考文獻:Sijian Yu, Tong Lin, Danian Nie, et al. Dynamic assessment of measurable residual disease in favorable-risk acute myeloid leukemia in first remission,treatment, and outcomes. Blood Cancer J. 2021 Dec 6;11(12):195. doi: 10.1038/s41408-021-00591-4.